Didáctica de la nomenclatura química, un enfoque sistemático (página 2)
DESARROLLO
CRONOLÓGICO DE LA NOMENCLATURA
QUIMICA
Los nombres usados para varios compuestos
químicos eran antiguas reliquias de los días en que
la alquimia se encontraba en su apogeo. Nombres como "polvo
de ", "sal de Alembroth", "agua
fagedênica" o "colcotar"
nada revelaban sobre los componentes de un producto
químico, o sobre la relación entre los diferentes
productos.
Observamos nombres como "óleo de tártaro por el
campana", "óleo de
vitríolo", "mantequilla de
antimônio" o flôres "de zinc"
son aún más
indecifrables, porque nos conducen a ideas
erradas. Lejos de que se relacionen con el óleo,
mantequilla o flores, tales productos son, en su mayor parte,
venenos poderosos.
El sistema de nomenclatura emergente
estableció nombres que expresaban la naturaleza
química o
la composición de la sustancia. Como primer paso, todos
los productos químicos fueron divididos en dos clases, los
elementos y los compuestos (según Boyle). Los elementos
incluían las sustancias más simples o fundamentales
"aquellas que los químicos no fueron capaces de
decomponer". Los compuestos eran
sustancias formadas de dos o más elementos, debiendo ser
designados "por la reunión de los nombres de aquellos
elementos combinados".
El oxígeno, cuyo nombre etimológico
hace referencia a dos voces griegas que significan generador
de ácidos, pues se creía, erradamente, que el
oxígeno era un componente de todos los ácidos.
La nomenclatura funcional probablemente se inició
con los ácidos del azufre, ya que se utilizó
ácido sulfúrico, para designar el máximo
contenido de oxígeno posible, y ácido
sulfuroso para designar el ácido
que contiene menos oxígeno. De acuerdo con el nuevo
método,
los sufijos "ico"
y "oso" indican mayor o menor cantidad de oxígeno,
cuando la sustancia puede combinarse con el oxígeno en dos
cantidades diferentes.
El oxígeno, el elemento más abundante de
la tierra,
ocupó un lugar
prominente en el nuevo sistema. Sus
compuestos incluían antes de todo y principalmente, los
óxidos, formados cuando otro elemento se combina
con el oxígeno. Una clase
importante de los óxidos era los óxidos
ácidos, es decir, sustancias que se disuelven en
el agua para
formar ácidos que tornan de color rojo el
papel de
tornasol. Entre esos están los
óxidos de azufre, de carbono, de
nitrógeno, de fósforo y de otros no metales. Opuestos
a los óxidos ácidos estaban los óxidos de
metales, que eran llamados óxidos básicos, y
que se disolvían en el agua para formar soluciones
alcalinas. Entre ellos estaban los óxidos de potasio, de
sodio, y de otros metales, cuyos óxidos en solución
torna de color azul el papel tornasol. Algunos de esos
óxidos básicos, como la cal viva (óxido de
calcio), se unen con el agua para formar compuestos más
complejos llamados hidróxidos.
Cuando un óxido básico reacciona con un
ácido, se forma una sustancia llamada sal. Estos fueron
designados de acuerdo con el ácido u óxido
ácido del cual derivan. Para
ilustrar, sulfato es el nombre general dado a todas las
sales formadas por el ácido sulfúrico,
correspondiendo el sufijo "ato" a un mayor contenido de
oxígeno. El término
sulfito se refiere a las sales
formadas por el ácido
sulfuroso, de contenido de
oxígeno más bajo. Así, los nombres
"sulfato de cobre" y "sulfito de cobre" indican el
ácido y el metal del cual derivan.
El nuevo método de clasificar los productos
químicos fue más que un nuevo conjunto de nombres
para los compuestos. Nos Ayuda a comprender como un producto
puede ser obtenido o utilizado, y lo que tiene en común
con los productos relacionados. Llamar a los productos
químicos
litargirio o
galena, poco o nada en los dice sobre su
composición química. Pero sus nuevos nombres,
óxido de plomo sulfuro de plomo (hoy,
sulfuro de plomo II) contiene una riqueza
de información. Ante todo, los nuevos nombres
indican que ambos contienen plomo. Además de eso, sabemos
que muchos
sulfuros pueden ser convertidos en
óxidos, cuando son calentados con el oxígeno en
ambientes cerrados.
Jöns Jacob, barón Berzelius (1779 –
1848)

Químico sueco, considerado como una de las
mayores autoridades en química de su época.
Estudió medicina en
la Universidad
de Uppsala, adquiriendo sus primeros conocimientos en
química por la lectura
de un libro
contrario a la teoría del flogisto.
La contribución más importante de
Berzelius a la química moderna es la introducción de una formulación
química muy similar a la utilizada actualmente. La
reforma química que tratamos arriba fue completada en 1814
cuando
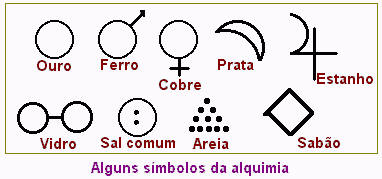
Berzelius eliminó los antiguos
símbolos de la
alquimia que eran usados para las
sustancias químicas. Abajo ilustramos algunos de los
extraños símbolos y señales
enigmáticas que aún eran usados en el tiempo
de
Lavoisier.
Stanislao Cannizzaro
(1826-1910)

Químico italiano nacido en Palermo. En 1860,
valiéndose de las teorías de Avogadro y Gay Lussac y
utilizando la tabla de Berzelius, propuso su teoría
para fijar símbolos para los elementos a partir de la
inicial de su nombre latino, a la que se añadía
una segunda inicial cuando fuera necesario. Esta propuesta,
que incorporaba subíndices que indicaban los
átomos de cada especie presentes en la sustancia,
revolucionó el lenguaje
químico al propiciar la aparición de las
fórmulas.
- La formalización de la Nomenclatura
Química Funcional fue el resultado de ocho meses de
trabajo
intensivo por cuatro químicos franceses, Guyton de
Morveau, Lavoisier, Berthollet, y Fourcroy quienes se
encontraron casi diariamente de julio de 1786 hasta su
publicación en 1787. Antes de este trabajo, la misma
sustancia podría tener tantos como 12 nombres
diferentes, mientras no teniendo ninguna relación
principalmente a la sustancia. El objeto principal de la
Nomenclatura era presentar una vista sistemática del
nuevo sistema de Lavoisier de química y proponer un
sistema más racional de nombrar los compuestos
químicos. La Nomenclatura de Lavoisiser introdujo los
nombres como el hidrógeno, oxígeno, cloruro de
sodio, y el sulfato férrico que todavía
están en el uso hoy.

NOMENCLATURA Y
FORMULACIÓN DE COMPUESTOS QUÍMICOS
Para la inteligencia
una palabra es suficiente, escribió Benjamin Franklin. Si
usted es un estudiante de química, inteligente, le tenemos
una sola palabra: NOMENCLATURA. En realidad, la
nomenclatura son muchas palabras, pero si desea aprender lo
relacionado con la química y estar en condiciones de
comunicarse fluidamente, deberá comprender las palabras
que forman el lenguaje de la
química.
La nomenclatura constituye el conjunto de
reglas pre-establecidas internacionalmente mediante las cuales se
debiera asignar nombres unívocos a las sustancias
simples o compuestas. Distinguiremos tres tipos de
nombres:
El Nombre Común o Vulgar es todo nombre no
ajustado a un sistema prefijado y que está muy arraigado
en el lenguaje químico convencional. Generalmente hace
referencia a la etimología, origen, propiedad
notable o reglas en desuso, por lo que se recomienda
memorizarlos.
Fórmula | Nombre vulgar | Usos |
NaOH | Soda caústica | Manufactura de papel, |
NH3 | amoníaco | Fertilizantes, fibras, plásticos, explosivos, |
H2O | agua | Solvente universal |
Ca(OH) 2 | Cal apagada | Manufactura de metales, control de la |
H3PO4 | Ácido | Fertilizantes, detergentes, |
El Nombre Funcional es el que resulta de la
combinación de dos palabras que establecen la
identificación de un compuesto, basándose en la
función
química que lo constituye. El primer vocablo indica el
nombre genérico y el segundo, el
nombre específico, indicativo de la especie
química concreta de la que se trata.
……………………
[ de ]
………………………
nombre genérico nombre
específico
Fórmula | Nombre | Usos |
H2SO4 | ácido | Fertilizantes, manufactura de productos |
Na2CO3 | Carbonato de sodio | Detergentes, vidrios, |
HNO3 | Ácido | Fertilizantes, plásticos, |
SO2 | Anhídrido | Contaminante |
Este tipo de nomenclatura si bien se encuentra muy
arraigado en casos concretos, se pretende que desaparezca por ser
arbitrario, ambigua en algunos casos y requerir de un gran
número de excepciones.
El nombre sistemático es el que indica la
naturaleza y las proporciones de los constituyentes de una
sustancia. Está formado a base de un sistema de prefijos y
sufijos, que indican en el primer caso la estequiometría y en el segundo caso la
naturaleza de las especies implicadas.
Fórmula | Nombre | Usos |
BCl3 | Tricloruro de boro | Producción de compuestos |
CO | Monóxido de | Serio contaminante del |
N2O4 | Tetróxido de | Componente del combustible para |
NO2 | Dióxido de | Serio contaminante |
La estequiometría de los constituyentes en
un compuesto puede indicarse directamente, haciendo uso de
prefijos numerales, o indirectamente, mediante el sistema stock.
Los prefijos numerales sólo pueden utilizarse cuando en
una sustancia existen varios constituyentes idénticos. Si
los constituyentes son monoatómicos, los prefijos
son:
Prefijo | Numeral |
Mono | 1 |
di | 2 |
tri | 3 |
tetra | 4 |
penta | 5 |
hexa | 6 |
hepta | 7 |
octa | 8 |
nona | 9 |
deca | 10 |
El sistema stock consiste en colocar entre
paréntesis, e inmediatamente después del nombre del
elemento un número romano que indique el estado de
oxidación del mismo.
Fórmula | Sistema Stock | Usos |
SO3 | óxido de azufre | Fabricación de |
N2O | óxido de nitrógeno | Anestesia, oxidante para |
CO2 | óxido de carbono ( IV | Efecto invernadero |
PROPUESTA PARA
LA ENSEÑANZA DE LA NOMENCLATURA
INORGÁNICA
NOMENCLATURA DE IONES
MONOATÓMICOS
a. Los iones monoatómicos
positivos cuyos elementos presentan un sólo grado de
oxidación, reciben el nombre del elemento sin
alterarlo.
b. Los iones monoatómicos positivos
cuyos elementos presentan más de un grado de
oxidación positivo reciben el nombre del elemento,
ubicando entre paréntesis un número romano que
indique el grado de oxidación del elemento.
Si se trata de metales con dos grados de
oxidación positivos se pueden usar alternativamente las
terminaciones "ico" y "oso" para indicar el
"mayor" y "anterior" grado de oxidación
respectivamente.
c. Los iones monoatómicos negativos,
reciben el nombre del elemento terminado en el sufijo
"uro".
Nota: Cuando se utilizan sufijos en la nomenclatura de
los siguientes elementos se tiene que usar su nombre
latino.

Veamos algunos ejemplos de la nomenclatura de iones
monoatómicos:
Ion | Nomenclatura |
Fe3+ | Ion hierro |
Fe2+ | Ion hierro (II) o ión ferroso |
Sn2+ | Ion estaño (II) o ión |
S 2- | Ion sulfuro |
H 1+ | Ion hidrógeno |
K 1+ | Ion potasio |
Ca2+ | Ion calcio |
Al3+ | Ion aluminio |
Cu2+ | Ion cobre |
Pb2+ | Ion plomo (II) o ión plumboso |
Br 1- | Ion bromuro |
Ciertos iones presentan nombres comunes muy arraigados
en el lenguaje químico convencional, por lo que se
recomienda memorizarlos.
Ion | Nomenclatura |
O 2- | Ion óxido |
OH 1- | Ion |
NH41+ | Ion amonio |
CN | Ion cianuro |
Algunos iones son de uso cotidiano y también es
conveniente memorizarlos:
Ión | Nomenclatura |
SO4 | Ion sulfato |
NO3 | Ion nitrato |
PO4 | Ion fosfato |
ClO3 | Ion clorato |
CO3 | Ion carbonato |
HCO3 | Ion bicarbonato |
CH3COO | Ion acetato |
NOMENCLATURA DE COMPUESTOS
a. A efectos de nomenclatura
primero se nombra la especie que aparentemente carga negativa,
a partir de ahora denominaremos "especie negativa"; y luego se
menciona la especie que aparenta carga positiva a partir de
ahora denominaremos "especie positiva".
……………………….. [de]
………………………..
especie negativa especie
positiva
b. A efectos de formulación primero se
escribe la especie que apararenta carga positiva, a partir de
ahora denominaremos "especie positiva" y luego la especie
que aparenta carga negativa, a partir de ahora denominaremos
"especie negativa".

Donde X e Y se pueden simplificar si son
múltiplos entre sí.
En el caso de compuestos binarios donde los dos
elementos son no metálicos se recomienda usar prefijos
multiplicadores: mono*, di, tri, tetra, etc. para indicar
que cada especie se repiten: 1, 2, 3, 4, etc. Veces,
obviando los números romanos si estuvieran
implicados.
Nota: * El prefijo "mono" sólo se
utiliza cuando la estequiometría del compuesto es 1 a
1.
** Para compuestos binarios se puede utilizar los
prefijos "sesqui" y "hemi" para indicar la
estequiometría 2 a 3 y 2 a 1,
respectivamente.
Veamos algunos ejemplos:
1. FeCl3
Solución:
![]()
2. Co2O3
Solución:

3. Co(OH)3
Solución:
![]()
4. P2O5
Solución:
![]()
5. Cl2O7
Solución:
![]()
6. CO
Solución:
![]()
- FeSO4
Solución:
![]()
Nota final: Sólo se ha propuesto la
formulación y nomenclatura básica con un
método sistemático, asignando los nombres
más usados en el lenguaje químico convencional,
no necesariamente implica reglas estrictas de la IUPAC, y
lomas importante, sin recurrir a la nomenclatura
funcional.
A continuación se proponen algunas referencias
bibliográficas y direcciones electrónicas del
internet.
1. Proponer una discusión y/o conclusiones sobre
la nomenclatura funcional.
- Referencias históricas
- Funciones químicas
- Ventajas de la nomenclatura funcional
- Desventajas
- Inconsistencias
http://www.uv.es/~bertomeu/pub/garcia-bertomeu1998.pdf
http://www2.uah.es/edejesus/resumenes/QG/nom_quim.pdf
http://tiny.uasnet.mx/prof/cln/quimica/alberto/indice.html
http://www.medtrad.org/panacea/IndiceGeneral/n11-tribunagarriga.pdf
http://perso.wanadoo.es/frq/formulacion/indice.html
- Proponer una discusión sobre las propiedades
de los óxidos y buscar las aplicaciones industriales de
2 óxidos básicos, 2 óxidos ácidos 2
óxidos neutros.
- Proponer la discusión sobre las propiedades y
nomenclatura de los ácidos y buscar las aplicaciones de
4 ácidos.
- Nomenclatura tradicional
- Nomenclatura sistemática
- Propiedades
http://pc32-96.op.upm.es/formulae/
http://www3.planalfa.es/fec/aa/quimicaT1.htm
http://www.rena.e12.ve/terceraetapa/quimica/SustQuimicas.html- Proponer una discusión sobre los elementos y
compuestos más importantes en la
geósfera. - Adquirir adiestramiento en el uso de los siguientes
tutoriales
de nomenclatura:
http://fresno.cnice.mecd.es/%7Eearanda/formula/principal.htm
http://www.eis.uva.es/~qgintro/nomen/nomen.html
http://usuarios.lycos.es/alonsoquevedo/formulainorganica/
Demo de nomenclatura quimica
http://www.crocodile-clips.com/demo_download.do?id=21
1.- Formular y nombrar según
la nomenclatura tradicional y la IUPAC, cada una de las
siguientes sales que completarían el siguiente
cuadro:
Al+3 | Mg+2 | Na+ | Cu+ | Cu+2 | Fe+3 | NH4+ | |
SO4-2 | |||||||
NO2 | |||||||
CrO4-2 | |||||||
NO3 | |||||||
PO4-3 | |||||||
PO3 | |||||||
S-2 | |||||||
CO3 | |||||||
ClO3 | |||||||
ClO | |||||||
P2O7-4 | |||||||
Cl – | |||||||
OH – | |||||||
Cr2O7 | |||||||
CrO4 | |||||||
S2O7 |
2. Determinar si cada una de las siguientes
analogías fórmula-nomenclatura son correctas
(C) o incorrectas ( I ), según sean el caso. No
sólo debe considerar si el nombre es estrictamente
correcto, sino también que sea de uso cotidiano en el
lenguaje químico convencional.
1.- Fe2O3 : trióxido de dihierro ( )
2.- VCl3 : cloruro vanádico ( )
3.- N2O3 : anhidrido nitroso ( )
4.- CaSO3 : sulfito de calcio ( )
5.- Na2B4O7 : ortoborato de sodio ( )
6.- NaPO3 : fosfato de sodio ( )
7.- Na4P2O7 : difosfato de sodio ( )
8.- FeO : monóxido de hierro ( )
9.- NaBO2 : metaborito de sodio ( )
10.- CuCl2 : dicloruro de cobre ( )
11.- CuBr : bromuro de cobre(I) ( )
12.- Fe(NO3 )2 : nitrato férrico ( )
13.- FeCl3 : tricloruro férrico ( )
14.- SnF2 : fluoruro de estaño
(II) ( )
15.- HgCO3 : carbonato de mercurio(II) ( )
16.- P4O10 : óxido de
fósforo(V) ( )
17.- HNO2 : ácido nitroso ( )
18.- H2SO3 : ácido sulfuroso ( )
19.- H2S2O7 : ácido
disulfúrico ( )
20.- HBr(g) : ácido
bromhídrico ( )
21.- H3PO3 : ácido ortofosforoso ( )
22.- Ca(HSO4)2 : sulfatoácido de
calcio ( )
23.- HF(ac) : ácido
fluorhídrico ( )
24.- HBrO3 : ácido brómico ( )
25.- Ba(NO3)2 : nitrato de bario ( )
26.- PbI2 : yoduro de plomo(II) ( )
27.- MgSO4 : sulfato de magnesio ( )
28.- CdCrO4 : cromato de cadmio ( )
29.- BiCl3 : cloruro de bismuto ( )
30.- NiS : sulfuro de niquel(II) ( )
31.- Ca3N2 : nitrato de calio ( )
32.- K2Cr2O7 : pirocromato de potasio ( )
33.- Sn(NO3)2 : nitrato estánnico ( )
34.- NaOH : soda caústica ( )
35.- HgCl2 : cloruro de mercurio ( )
3.- 36.- Cd(NO2)2 :
nitrito de cadmio ( )
37.- Cr(OH)6 : hidróxido
crómico ( )
38.- LiAlH4 : hidruro de litio y aluminio ( )
3. Determine si cada una de las siguientes proposiciones
son falso (F) o verdadero (V), según
corresponda:
1.- El nitrito de sodio presenta mayor atomicidad que el
nitrato de sodio. ( )
2.- El fosfato de amonio presenta mayor atomicidad que
el tetraborato de sodio ( )
3.- El trisilicato de sodio presenta mayor atomicidad
que el metafosfato de sodio trihidratado ( )
4.- El hidrógenocarbonato de sodio decahidratado
presenta mayor atomicidad que el sulfato de aluminio
hexahidratado ( )
5.- El sulfato de magnesio heptahidratado presenta mayor
atomicidad que el carbonato de hierro( II ) dihidratado.
( )
6.- El sulfato doble de amonio y hierro(II) presenta
mayor atomicidad que el hexaóxido de
tetrafósforo ( )
7.- El cromito de sodio presenta menor atomicidad que el
metaborato de sodio dihidratado. ( )
8.- El átomo de
fósforo en el dihidrógenodifosfato de sodio y en el
metafosfato de potasio presenta grado de oxidación
+5. ( )
9.- El tetróxido de dinitrógeno, N2O4, y
el dióxido de nitrógeno, NO2, representan el mismo
compuesto. ( )
10.- En un compuesto todos los átomos de un
determinado elemento deben tener el mismo grado de
oxidación. ( )
B. OPCIÓN MÚLTIPLE. Elija la
respuesta correcta para cada una de las siguientes
proposiciones:
11. Determinar el nombre del siguiente ácido:
HClO2
a) Ácido clorhídrico b) Ácido
hipocloroso c) Ácido cloroso
d) Ácido clórico e) Ácido
perclórico
12. Determinar el nombre del siguiente ácido:
H2SO3
a) Ácido sulfhídrico
b) Ácido hiposulfuroso
c) Ácido sulfuroso
d) Ácido sulfúrico
e) Ácido peroxosulfúrico
13. Determinar el estado de
oxidación del cloro en el siguiente compuesto:
HClO2
a) 1+ b) 3+ c) 5+ d) 7+ e) 1-
14. El óxido plumboso tiene por fórmula
……. y el Au2O tiene por nombre
….
a) PbO ; óxido auroso
b) PbO2 ; óxido auroso
c) PbO ; óxido áurico
d) PbO2 ; óxido áurico
e) PbO4 ; óxido áurico
15. El hidróxido cúprico tiene por
fórmula… y el Fe(OH)2 tiene por nombre
……
a) Cu OH ; hidróxido férrico
b)Cu OH ; hidróxido ferroso
c) Cu (OH)2 ; hidróxido ferroso
d) Cu (OH)2 ; hidróxido
férrico
e) Cu (OH)3 ; hidróxido
férrico
16. Un óxido metálico es
pentatómico. Determinar la atomicidad del
hidróxido que forma, si el elemento metálico
actúa con el mismo estado de
oxidación.
a) 2 b) 3 c) 5 d) 7 e) 9
17. Las atomicidades del ácido nítrico y
del ácido carbónico son
respectivamente
a) 5 y 5 b) 5 y 6 c) 4 y 5 d) 4 y 6 e) 3 y
5
18. Las atomicidades del ácido hipocloroso y
del ácido fosfórico son
respectivamente:
a) 3 y 5 b) 4 y 5 c) 3 y 8 d) 4 y 8 e) 3 y
7
19. Señalar al ácido con mayor
atomicidad:
a) Ácido nítrico
b) Ácido carbónico
c) Ácido hipobromoso
d) Ácido fosfórico
e) Ácido sulfuroso
20. Señalar al ácido con mayor cantidad
de átomos de oxígeno por
molécula:
a) Ácido perclórico
b) Ácido nítrico
c) Ácido bromoso
d) Ácido carbónico
e) Ácido sulfuroso
21. Señalar verdadero (V) o falso (F)
según corresponda:
* El ácido clorhídrico es un
ácido hidrácido.
* El ácido bromhídrico no es un
ácido oxácido.
* El ácido sulfúrico es un
ácido hidrácido.
a) VVV b) VVF c) VFF d) FFF e) FVV
22. Con respecto al siguiente compuesto: H2SO4.
Señalar verdadero (V) o falso (F) según
corresponda:
* Es el ácido sulfhídrico
* El estado de oxidación del azufre es
6+
* Es un ácido oxácido
a) VVV b) VVF c) VFF d) FFF e) FVV
23. Con respecto al siguiente compuesto: HBr.
Señalar verdadero (V) o falso (F) según
corresponda:
* Es el ácido brómico
* El estado de oxidación del bromo es
(1-).
* No es un ácido oxácido
a) VVV b) VVF c) VFF d) FFF e) FVV
24. Con respecto al Ion clorito, señalar
verdadero (V) o falso (F) según corresponda:
* Proviene del ácido
clórico
* Su representación es la siguiente:
ClO21-
* Se forma a partir de un ácido
oxácido
a) VVV b) VVF c) VFF d) FFF e) FVV
25. Con respecto al ion perbromato, señalar
verdadero (V) o falso (F) según corresponda:
* Proviene del ácido
perbrómico
* Su representación es la siguiente
BrO31-
* Se forma a partir de un ácido
hidrácido
a) VVV b) VVF c) VFF
d) FFF e) FVV
26. Con respecto al ión carbonato,
señalar verdadero (V) o falso (F) según
corresponda:
* Proviene del ácido
carbónico.
* Su representación es la siguiente
CO32-
* Se forma a partir de un ácido
oxácido.
a) VVV b) VVF c) VFF d) FFF e) FVV
27. Con respecto al carbonato de calcio,
señalar verdadero (V) o falso (F) según
corresponda:
* Es una sal oxisal.
* El carbono actúa con estado de
oxidación (4+)
* Se podría formar a partir del ácido
carbónico y el hidróxido de calcio.
a) VVV b) VVF c) VFF d) FFF e) FVV
28. Con respecto al sulfato de sodio, señalar
verdadero (V) o falso (F) según corresponda:
* Es una sal haloidea
* El azufre actúa con estado de
oxidación (6+)
* Se podría formar a partir del ácido
sulfúrico y el hidróxido de sodio
a) VVV b) VVF c) VFF d) FFF e) FVV
29. Determinar el nombre del compuesto que se forma al
reaccionar el hidróxido férrico y el ácido
nítrico, si todos los átomos se mantienen con su
mismo estado de oxidación.
a) Nitrito ferroso.
b) Nitrato férrico.
c) Nitrito férrico.
d) Nitrato ferroso.
e) Ferrato nítrico.
30. ¿ Qué analogía es
correcta?
a) Fe2O3 : Hemióxido de hierro
b) N2O4 : Óxido de
nitrógeno(IV)
c) NH4OH : Hidróxido de
amoníaco
d) N2O3 : Sesquióxido de
nitrógeno
e) CO : Óxido carbonoso
31. ¿Cuál de los siguientes compuesto
presenta átomos con grado de oxidación
–3?
a) Tricloruro de fósforo
b) Nitruro de calcio
c) Nitrito de potasio
d) Sulfito de calcio
e) Perclorato de plomo(II)
32. ¿Qué analogía es
incorrecta:
a) Ba2+ : Ion bario
b) S 2- : Ion sulfuro
c) Cr3+ : Ion crómico
d) Mn7+ : Ion permangánico
e) H – : Ion hidruro
33. La fórmula de peróxido de Bario
es:
a) BaO b) BaO2 c) Ba2O d) Ba2O3 e) Ba3O2
34. El nombre adecuado del compuesto Fe2(SO4)3
es:
a) Sulfuro de hierro.
b) Sulfito de hierro.
c) Bisulfato de hierro.
d) Sulfato de hierro (II).
e) Sulfato de hierro (III).
35. En el ácido disulfúrico, los
átomos de hidrógeno, de oxígeno y de
azufre están respectivamente en la proporción
de:
a) 2 : 1 : 4 b) 1 : 2 : 4 c) 2 : 2 : 7 d) 2 : 3 : 1
e) 3 : 2 : 9
36. Calcular el número de oxidación del
fósforo en los siguientes compuestos:
PH3, Mg(H2PO2)2, Ca3(PO4)3
a) 3+, 1+, 5+ b) 3-, 1+, 5+
c) 3-, 3+, 3+ d) 3+, 5-, 5-
e) 5+, 5+, 5+
37. Relacionar correctamente:
I.- Fe(NO3)3.6 H2O
II.- AlH3
III.- NaHCO3.10 H2O
IV.- HPO3
V.- K2MnO4
a) Ácido fosfórico.
b) Hidrogenocarbonato de sodio
decahidratado.
c) Permanganato de potasio.
d) Nitrato de hierro (III)
hexahidratado.
e) Ácido metabórico.
f) Hidruro de alumnio.
g) Ácido metafosfórico.
h) Carbonato de sodio decahidratado.
i) Manganato de potasio.
a) I – d, II – f, III – g, IV – a, V – i
b) I – d, II – f, III – b, IV – a, V – c
c) I – d, II – f, III – b, IV – g, V – i
d) I – d, II – f, III – b, IV – e, V – c
e) I – d, II – f, III – g, IV – e, V – i
38. A continuación, se proponen fórmulas
de compuestos con sus respectivos nombres. Determinar.
¿Cuántas no están asociadas
correctamente?
* Na2S2O7 : Disulfato de sodio
* Cr(OH)3 : Hidróxido
crómico
* As2S3 : Sulfuro de arsénico
(III)
* FeCO3.2H2O : Carbonato ferroso
dihidratado
* P4O10 : Óxido de
fósforo(V)
* BaO2 : Óxido de bario
a) 2 b) 3 c) 4 d) 5 e) 6
39. A continuación, se proponen fórmulas
de compuestos con sus respectivos nombres. Determinar.
¿Cuántas no están asociadas
correctamente?
* N2O : Óxido nitroso
* Cr(OH)6 : Hidróxido de
cromo(VI)
* PbS4 : Sulfuro plomo (IV)
* BaSO4 : Sulfato de bario
* HB5O8 : Ácido
pentabórico
* CuH : Hidruro de cobre(II)
a) 2 b) 3 c) 4 d) 5 e) 6
40. Al fosfatodiácido de potasio, corresponde
la fórmula:
a) K2HPO4 b) KH2PO4 c) KH2PO3
d) KH2PO2 e) KH2PO3
41. ¿Qué sal presenta mayor
atomicidad?
a) Carbonato manganoso.
b) Ortofosfato de amonio.
c) Clorato de calcio.
d) Trisilicato de sodio.
e) Bisulfito de sodio.
42. El proceso por
el cual los cristales hidratados pierden su agua de
hidratación al quedar expuestos al aire se
denomina:
a) Evaporación b) Delicuescencia
c) Eflorescencia d) Desecación
e) Higroscopia
43. ¿Qué proposición es falsa,
respecto al bicarbonato de sodio decahidratado?
a) Su atomicidad es
36.
b) Su atomicidad es mayor que la del tetraborato de
sodio decahidratado.
c) Es una sal oxisal ácida.
d) Presenta mayor atomicidad que el ortofosfato de
sodio.
e) Contiene un átomo con grado de
oxidación +4.
44. ¿Cuál de las siguientes alternativas
es falsa con respecto al ácido cromoso?
a) Puede formar sales ácidas.
b) Genera oxisales.
c) Su atomicidad es menor que la del acido
clórico.
d) Puede formar el cromito de potasio.
e) Tiene menor atomicidad que el hidróxido
de calcio.
45. Los números de oxidación del
oxígeno en cada una de las siguientes sustancias: OF2,
H2O2 y CaO2 son respectivamente:
a) 2-, 2-, 2- b) 2-, 1-, 1- c) 2+, 1-, 1-
d) 2+, 1-, 2- e) 0, 2+, 2-
46. Los números de oxidación del
hierro en el (NH4)3(Fe(CN))6] y del cobre en el
[Cu(NH3)4]SO4, son respectivamente:
a) 3+ y 2+ b) 6+ y 4+ c) 2+ y 1+
d) 3- y 2+ e) 2+ y 4+
47. ¿Cuál de las siguientes series
contienen sólo ácidos oxácidos normales,
poliácidos y/o polihidratados?
a) Cl2; CO2; SO3; As2O3
b) HIO3; H2S; H2SO4; HNO3.
c) H3BO3, CaCO3, H3PO4, H2SO3
d) HClO3, HBr, HI, KNO3.
e) H3BO3, HNO2, H3PO2, HIO
48. En el compuesto dihidrógenofosfato de
calcio, el fósforo actúa con grado de
oxidación:
a) 1+ b) 4+ c) 3+
d) 2+ e) 5+
49. ¿Con qué grado de oxidación
actúa el boro en los siguientes compuestos: HB5O8,
LiBH4, Na2B4O7 . 10H2O.
Sobre el autor:
Jorge Luis Breña Oré
Lic. Quím.
http://www.jbrenaore.galeon.com
Licenciado en Química
Académico & Investigador &
Organizador
- Químico. Licenciado con
excelencia.Catedrático de la Universidad Nacional de
Ingeniería. Lima-Perú - Cátedras:
- Química General –
Preuniversitaria - Química Orgánica I.
Química Orgánica II. - Análisis Químico
instrumental.
- Química General –
- Ejecutor de Proyectos de
Investigación - "Desarrollo Tecnológico de Aceites
Esenciales". - Ejecutor del proyecto
"Gestión de Residuos Químicos
de un Laboratorio Químico".
- "Desarrollo Tecnológico de Aceites
- Participante activo del Comité Nacional de
Normalización para Envases
Plásticos en contacto con alimentos
(IPENBAL-INDECOPI).Experto en TICs (Tecnología de la información
comunicación) - Organizador y expositor en cursos de
actualización para la implementación de aulas
virtuales para el ejercicio de la Docencia.Premiado con el 7mo
puesto a nivel mundial en la plataforma Dokeos, por
el diseño de aulas virtuales.Organizador
y expositor en cursos de actualización para la
elaboración de test
online en Hot Potatoes.Organizador y expositor en cursos de
actualización para la enseñanza de software
químico: Chemsketch. - Experto en elaboración de aulas virtuales
reusables scorm-reload.
- Organizador y expositor en cursos de
- Asesor técnico en formulación de
productos cosméticos y de limpieza. - Organizador y expositor de talleres educativos y de
capacitación profesional: UNI,
Sociedad
Química del Perú. - Productos Naturales.
- Aceites esenciales: Extracción,
Purificación y Caracterización. - Elaboración de Productos Cosméticos
y de Limpieza. - Nomenclatura Inorgánica, Reacciones y
Estequiometría. - Software de aplicación para
Química: chemsketch
- Publicaciones
- Nomenclatura Química – Método
Sistemático - Estequiometría
- Química de los cosméticos
(Recopilación). - Manual de Laboratorio de QUÍMICA
ORGÁNICA I - Manual de Laboratorio de QUÍMICA
ORGÁNICA II - Manual de Laboratorio de ANÁLISIS
QUÍMICO INSTRUMENTAL - Manual de Laboratorio de PRODUCTOS
NATURALES - Manual de Laboratorio del curso de ACEITES
ESENCIALES - Manual de Laboratorio para la ELABORACION DE
PRODUCTOS COSMETICOS Y DE LIMPIEZA
 Página anterior Página anterior |   Volver al principio del trabajo Volver al principio del trabajo | Página siguiente  |
