Propiedades físicas de los alcanos Obtención industrial Métodos de preparación

PROPIEDADES
FÍSICAS DE LOS ALCANOS
Las propiedades físicas de los alcanos siguen el
mismo patrón establecido por el metano, siendo
concordantes con las estructuras de
los alcanos. La molécula de un alcano sólo presenta
enlaces covalentes, que enlazan dos átomos iguales, por lo
que no son polares; o bien, unen dos átomos cuyas
electronegatividades apenas difieren, por lo que son escasamente
polares. Además, estos enlaces son direccionales de un
modo muy simétrico, lo que permite que dichas polaridades
débiles se cancelen; como resultado, un alcano es no polar
o ligeramente polar.
Las fuerzas que mantienen unidas las moléculas no
polares (fuerzas de Van der Waals) son débiles y de
alcance muy limitado; solamente actúan entre partes de
moléculas diferentes en contacto íntimo; es decir,
entre las superficies moleculares. Dentro de una familia
esperaríamos que cuanto mayor sea una molécula y
por consiguiente su superficie-, más intensa son las
fuerzas intermoleculares.
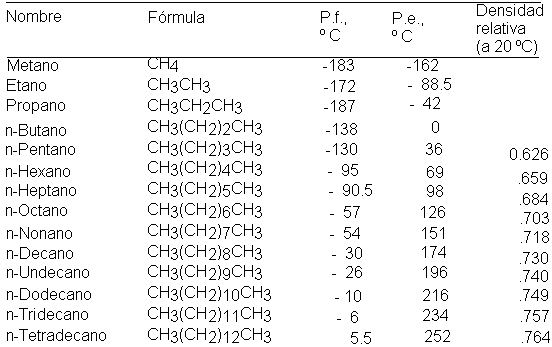
La siguiente tabla registra algunas constantes
físicas para unas pocas n-alcano. Podemos apreciar que los
puntos de ebullición y fusión
aumentan a medida que crece el número de carbonos. Los
procesos de
ebullición y fusión requieren vencer las fuerzas
intermoleculares de un líquido y un sólido; los
puntos de ebullición y fusión suben porque dichas
fuerzas se intensifican a medida que aumenta el tamaño
molecular.
Salvo para los alcanos muy pequeños, el punto
de ebullición aumenta de 20 a 30 grados por cada carbono que se
agrega a la cadena; veremos que este incremento de 20 a 30
grados por carbono.
El aumento del punto de fusión no es tan regular,
debido a que en un cristal las fuerzas intermoleculares no
sólo dependen del tamaño de las moléculas,
sino también de su ajuste en el retículo
cristalino.
Los cuatro primeros n-alcanos son gases; como
resultado del aumento del punto de ebullición y punto de
fusión con la longitud creciente de la cadena, los trece
siguientes (C5-C17) son líquidos, y
los de 18 átomos de carbono o más,
sólidos.
Las diferencias en los puntos de ebullición de
los alcanos con igual número de carbonos, pero estructura
distinta, son algo menores. En la siguiente tabla figuran los
puntos de ebullición de los butanos, pentanos y hexanos
isómeros; se aprecia que, en cada caso, un
isómero ramificado tiene un punto de ebullición
más bajo que uno de cadena recta y, además,
cuanto más numerosas son las ramificaciones, menor es el
punto de ebullición correspondiente. Así, el
n-butano hierve a 0ºC, y el isobutano, a -12ºC; el
n-pentano tiene un punto de ebullición de 36ºC; el
isopentano con una ramificación, 28ºC, y el
neopentano con dos, 9.5ºC. Este efecto sobre los puntos de
ebullición de las ramificaciones se observa en todas las
familias de los compuestos
orgánicos. El hecho de que una ramificación
baje los puntos de ebullición es razonable: con la
ramificación, la forma de la molécula tiende a
aproximarse a la de una esfera, con lo que disminuye su
superficie. Esto se traduce en un debilitamiento de las fuerzas
intermoleculares que pueden ser superadas a temperaturas
más bajas.
De acuerdo con la regla empírica, < < una
sustancia disuelve a otra similar>
> , los alcanos son solubles en
disolventes no polares como benceno, éter y cloroformo, e
insolubles en agua y otros
disolventes fuertemente polares. Considerándolos como
disolventes, los alcanos líquidos disuelven compuestos de
polaridad baja, pero no los de alta.
La densidad de los
alcanos aumenta en función
del tamaño, tiende a nivelarse en torno a 0.8, de
modo que todos ellos son menos densos que el agua. No es
de sorprender que casi todos los compuestos orgánicos sean
menos densos que el agua, puesto que, al igual que los alcanos,
están constituidos principalmente por carbono e hidrógeno. En general, para que una
sustancia sea más densa que el agua, debe contener un
átomo
pesado, como el bromo o el yodo, o varios átomos, como el
cloro.

Página siguiente  |

