k) ![]() a
a
![]()
b) 90 – 459.6 = – 369.6 °F ; ![]() = – 223.1
= – 223.1
°C ; -223.1 + 273 = 49.9 K
5.- ¿Cuando la temperatura de
un cuerpo aumenta en ![]() , ¿A
, ¿A
que corresponde este aumento en ![]() ? En
? En
![]() ?
?
15 (1) = 15 C | 273 + 15 = 288 K | 15 ( 1.8) = 27 F |
6.-A partir de la tabla VII, calcúlese el numero
de calorías requerido elevar la temperatura de
![]() g de cobre desde
g de cobre desde
![]() hasta
hasta
![]() .
.
Cal = ( 40 grs)( 0.092 cal/gr°c)( 50°c) = 184 cal
7.- ¿Cuántas calorías se requieren
para elevar la temperatura de una lb de agua desde
![]() hasta el punto
hasta el punto
de ebullición?
CAL = ( 454 GRS)( 1 CAL/GR°C)( 100°C) = 45400 CAL
8.- Calcúlese el calor especifico del agua en
unidades de ![]()
![]() (
(
![]() ) (
) (
![]() )
)
(![]() ) =
) =
![]() = 1.05 X
= 1.05 X
1010 ergios/lb ºF
9.- Suponiendo que no cambia el valor
especifico del hierro
calcúlese cuanta calorías si deberían ser
eliminadas para enfriar un mol Fe partiendo de ![]() hasta
hasta
![]()
Cal = ( 55.847 grs)(0.107 cal/gr°c)( – 248°C) = –
1481.95 cal
10.- ¿Cuál requerirá más
energía para separarse en sus moléculas
individuales, una sustancia a temperatura elevada o la misma
sustancia a una temperatura mas baja? Explíquese el
razonamiento
Para ponerla a una temperatura, porque una sustancia gasta mas
energía al bajar de temperatura
11.- Se necesita 80 cal para elevar en ![]() la temperatura
la temperatura
de ![]() de lana.
de lana.
¿Cuál es el calor específico de la
lana?
Ce= ![]() =
=
0.25 cal/gr °C
12.- Un metal desconocido tiene un calor especifico de
![]() .
.
¿Cuál es, aproximadamente el peso atómico
del metal? ¿A partir de la tabla de pesos atómicos
se podría adivinar cual podría ser este
metal?
peso A = ![]() = 40
= 40
gr/mol ; en este caso seria el calcio
13.- A partir del conocido peso atómico del
níquel ![]() ,
,
¿Cuál se estimaría que seria su calor
específico?
Ce = ![]() =
=
0.102 cal/gr ºC
14.- ¿Cuántos ergios se requieren para
elevar en ![]() la temperatura
la temperatura
de 1 molécula de agua?
1 molécula de H2O ( ![]() )
)
(![]() ) = 2.98 x
) = 2.98 x
10-23 grs
Cal = (2.98 x 10-23 grs)(1 cal/gr°c)( 1°C)
= 2.98 x 10-23 cal
2.98 x 10-23cal (![]() ) = 1.24 x
) = 1.24 x
10-15 ergios
15.- Calcúlese el calor de las siguientes
reacciones (Empleando los valores de
![]() de la tabla
de la tabla
![]() )
)
a)![]()
![]()
calor = 2(-7.4) – (2(21.5)) ] = – 14.8 – 43 = –
57.8 kcal / mol
b)![]()
calor = ( 2 (-68.4) – 94.4 ) – ( – 19.1 ) = ( –
136.8 – 94.4 ) + 19.1 = – 231.2 + 19.1 = – 212.1 kcal /
mol
c)![]()
a) calor = -28 – ( – 68.4) = – 28 + 68.4 = 40.4
kcal/mol
d)![]()
calor = – 20.2 – 54.3 = – 74.5 kcal/mol
e)![]()
calor = ( 2 ( -101.9 )) – ( 2 ( – 68.4)) = – 203.8 +
136.8 = – 67 kcal/mol
f)![]()
b) Calor = – 189.8 – ( – 5. 2) = – 189.8 + 5.2 = – 184.
6 kcal/mol
16.-Para las reacciones siguientes calcúlese el
calor de formación del compuesto aislado que en cada caso
no aparezca en la lis de la tabla ![]() :
:
a)![]() (Combustión de la nitroglicerina)
(Combustión de la nitroglicerina)
a. – 1330 = (12( – 94.4) + 12( -7.4) +
10 ( – 86.4)) – 4
C3H5(NO3)3
– 1330 = ( – 1132.8 – 88.8 – 684 ) –
4
C3H5(NO3)3
– 1330 = – 1905.6 – 4
C3H5(NO3)3
1905.6 – 1330 = – 4
C3H5(NO3)3
![]() =
=
C3H5(NO3)3
– 143.9 =
C3H5(NO3)3
b)![]() (fotosíntesis de la fructuosa)
(fotosíntesis de la fructuosa)
b. 676 =
C6H12O6 –
( 6 (- 94.4) + 6 ( – 68.4) )
676 =
C6H12O6 –
( – 566.4 – 410.4 )
676 = C6H12O6
+ 976.8
676 – 976.8 =
C6H12O6
– 300.8 =
C6H12O6
c)![]()
c. – 43 = 2
SO3 – ( 2 (- 70.2) )
– 43 = 2 SO3 + 140.4
– 140.4 – 43 = 2 SO3
– 183.4 = 2
SO3
![]() =
=
SO3
– 91.7 = SO3
d)![]()
d. – 30 = (
Na2SO4 + 2 ( – 68.4)
– ( 2( – 101.9 ) + ( – 189.8) )
– 30 = (Na2SO4 –
136.8 ) – ( – 203.8 – 189.8)
– 30 = (Na2SO4 –
136.8 ) + 393.6
– 393.6 – 30 =
(Na2SO4 – 136.8
)
– 423.6+ 136.8 =
Na2SO4
– 286.8 = Na2SO4
17.- Para la reacción mostrada en el problema 16
a), ¿Cuántos litros de oxigeno a TPS
se necesitan para producir ![]() de
de
calor?
500 kcal ( ![]() ) (
) (
![]() ) = 92.57 lts
) = 92.57 lts
de O2
18.- ¿Cuantos ![]() de
de
energía calorífica son requeridas por un vegetal
para producir ![]() de fructuosa
de fructuosa
(reacción anterior 16 b)?
50 grs de
C6H12O6 (
![]() ) (
) (
![]() ) = 187.7
) = 187.7
kcal![]()
19.- El calor de evaporación del agua es
![]()
¿Cuántas calorías se requieren para
vaporizar ![]() de agua?
de agua?
¿Cuál es el calor molar de vaporización del
agua]?
calorias = (540 cal/gr) ( 200 gr) = 108000 cal
cma = ( 540 cal/gr ) ( 18 gr/ mol ) = 9720 cal / mol ) = 9.72
kcal / mol
20.- El calor de fusión
del hielo es de ![]()
a) ¿Cuál es calor molar de fusión del
hielo?
a) cmh= ( 80 cal / gr ) ( 18 gr/ mol ) 1440 cal / mol
b) ¿Cuántas calorías se requieren
para fundir ![]() de
de
hielo?
( 80 cal/gr) ( 500 gr / mol ) = 40000 cal/ mol
c) ¿Cuántas calorías se requieren
para formar ![]() de agua desde
de agua desde
hielo a ![]() hasta vapor a
hasta vapor a
![]() (Para el calor
(Para el calor
de vaporización véase el problema 19)?
( 50 gr ) ( 80 cal/gr ) = 4000 cal
(50 gr) ( 1 cal/gr °C) ( 100 °C ) = 5000 cal
( 50 gr ) ( 540 cal/gr ) = 27000 cal
Σ = 36000 calorías
21.- Cuando ![]() (gas) y
(gas) y
![]() (gas)
(gas)
reaccionan para formar ![]()
(liquida), se liberan ![]() de calor
de calor
por mol de ![]() formada.
formada.
¿Seria mas o menos este el valor si usáramos como
materiales
iniciales ![]() liquido y
liquido y
![]() liquido?
liquido?
Explíquese
el valor seria menor porque al encontrarse en estado liquido
los reactivos se necesitaría menor energía de
combinación
22.- En un motor de
automóvil, se queman hidrocarburos
líquidos en el aire, para formar
![]() (gas) y
(gas) y
![]() (gas).
(gas).
¿Se produciría en la combustión mas o menos
energía si el ![]() producido
producido
se formara en el estado
liquido en el lugar del gaseoso? Explíquese.
NOTA: Los calores de combustión de la
mayoría de los hidrocarburos corresponden a unos
![]() por mol de
por mol de
![]() formada,
formada,
mientras que el calor de vaporización del agua es
![]() .
.
es mayor la cantidad de calor de combustión del
hidrocarburo que el de condensación del agua
23.- Si una persona se pone a
dieta para perder peso, ¿Perderá mas o menos peso
consumiendo alimentos muy
fríos o muy calientes? Explíquese.
al consumir alimentos mas fríos nuestro organismo
hace un mayor desgaste de energía que si estos
están a temperatura ambiente.
24.- ¿Cuánto trabajo es
desarrollado por una persona de ![]() , que asciende
, que asciende
una montaña hasta una altura de ![]() ?
?
(Considérese solo el trabajo en
contra de la gravedad) Explíquese la respuesta en pies-lb,
en ergios y en Kcal.
( 150 lb) ( 5000 pies ) = 750000 pies – lb
7.5 x 105 pies – lb ( ![]() ) = 240000
) = 240000
cal
2.4 x 105 cal ( ![]() ) (
) (
![]() ) = 1 x
) = 1 x
1013 ergios
25.- La velocidad
promedio de una molécula de ![]() a
a
![]() es
es
aproximadamente ![]() .
.
Calcúlese la energía cinética total de un
mol de gaseoso a ![]() , en
, en
calorías.
EC = ![]() =
= ![]() = 3.6 x
= 3.6 x
1010 ergios (![]() )=
)=
880.86 cal
CAPITULO VI
Las propiedades de
los gases
1.- La diferencia entre los dos brazos de un
manómetro de mercurio es
![]() . Si el brazo
. Si el brazo
mas bajo es expuesto a un gas, mientras el más alto es
evacuado, ¿Cuál es la presión
del gas en atmósferas?
![]()
2.- Si la diferencia entre los dos brazos del problema
anterior fuera ![]() ,
,
calcúlese la presión entre centímetros de
![]() : En
: En
atmósfera.
![]()
3.- Si un gas esta en cerrado por agua en lugar de un
manómetro de mercurio y el nivel del agua es puesta al gas
es 90cm. mas costo que otro
bazo que esta expuesto ![]() en
en
atm (densidad
![]() )
)

4.- Háganse la conversión siguiente:
a)![]() a
a
![]()
![]()
b)![]() a
a
![]()
![]()
c)![]() en
en
![]()
![]()
d)![]() a
a
![]()
![]()

5.- Un lingote de hierro descansa sobre una base cuya
área es ![]() . Si el
. Si el
volumen del
lingote es ![]() y la densidad
y la densidad
del hierro es ![]() , calcular la
, calcular la
presión sobre la base en ![]() .
.
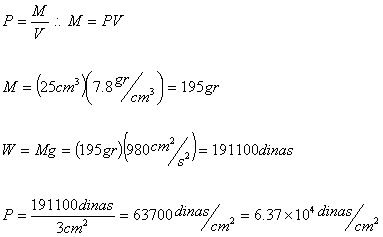
6.- El brazo de un fonógrafo pesa
![]() y descansa
y descansa
sobre una aguja cuya punta tiene un área de contacto de
![]()
calcúlese la presión ejercida por el brazo sobre un
disco, en ![]() .
.

7.- ¿Cuál es volumen ocupado por
![]() de gas a
de gas a
![]() después
después
de que asido comprimido a temperatura constante hasta
![]()

8.- ¿Qué presión se requiere para
comprimir ![]() de gas a
de gas a
temperatura constante hasta un volumen de ![]() si la
si la
presión inicial es de ![]() .
.

9.- Se calentaron ![]() de gas desde
de gas desde
![]() hasta
hasta
![]() a
a
presión constante ¿Cuál es el volumen
final?
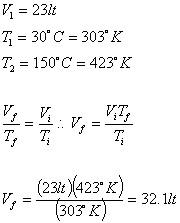
10.- ¿Hasta que temperatura deben enfriarse
![]() para que su
para que su
volumen disminuya hasta ![]() ? La
? La
![]() y el gas se
y el gas se
mantiene a presión constante.

11.- ¿Cuál es volumen de ![]() TPS de
TPS de
![]() a
a
![]() y a
y a
![]() de
de
presión?

12.- Se recolectaron por desplazamiento de mercurio
![]() de gas
de gas
Nitrógeno a ![]() y
y
![]() de
de
presión. ¿Cuál es volumen a TPS?

13.- ¿Cuál es la información que falta en los siguientes
problemas para
poder
resolverlos?
Un volumen de gas es comprimido desde ![]() hasta
hasta
![]() a temperatura
a temperatura
constante. ¿Cuál es el volumen final?
R=Volumen inicial
¿Qué volumen ocuparan ![]() de gas cuando
de gas cuando
se enfríen a ![]() y
y
presión constante?
R= Temperatura inicial
C) ![]() de gas a
de gas a
![]() se calientan a
se calientan a
![]() y a
y a
![]() de
de
presión. ¿Cuál fue la presión
inicial?
R= Volumen final
14.- Usando factores de conversión conviertase el
valor de R desde ![]() hasta
hasta
unidades de:
a)![]()
b)![]()
c)![]()
15.- Se a encontrado que ![]() de un gas
de un gas
desconocido a ![]() y a
y a
![]() pesan
pesan
![]() .
.
¿Cuál es su peso molecular?

16.- ¿Qué volumen ocupar ![]() gaseoso a
gaseoso a
![]() y a
y a
![]() de
de
presión?
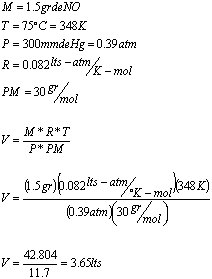
17.- Por desplazamiento de agua se han recogido
![]() de un gas a
de un gas a
![]() y la
y la
presión barométrica de ![]() . Si el gas
. Si el gas
tiene un peso de ![]() y la
y la
presión del vapor del agua a ![]() es
es
![]() ,
,
¿Cuál es peso molecular del gas?

18.- Por desplazamiento de acetona se recogen
![]() de un gas a
de un gas a
![]() y a
y a
![]() de
de
presión. Si el gas pesa ![]() y la
y la
presión del vapor de la acetona ![]() es
es
![]() .
.
¿Cuál es el peso molecular del gas?

19.- Se a encontrado la densidad de un gas es
![]() a
a
![]() y a
y a
![]() de
de
presión. ¿Cuál es su densidad a
TPS?

20.- La densidad del cloro gaseoso es ![]() a TPS.
a TPS.
¿Cuál es su densidad a ![]() y a
y a
![]() ?
?

21.- La presión de la atmósfera a
![]() arriba de
arriba de
la tierra es
de unos ![]() y la
y la
temperatura es cercana a ![]() .
.
¿Cuántas moléculas habrá en
![]() de un gas a
de un gas a
esa altitud?
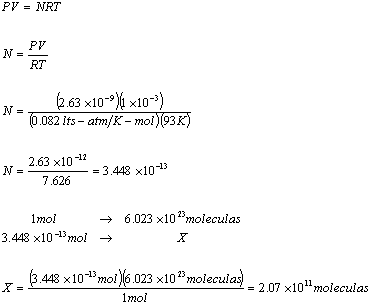
22.- ¿Cuál es la densidad del
![]() gaseoso a TPS,
gaseoso a TPS,
a ![]() y a
y a
![]() de
de
presión?

23.- Se ha encontrado que un gas desconocido tiene una
densidad ![]() veces mas
veces mas
grande que la del oxigeno ![]() a la
a la
misma T y P. ¿Cuál es su peso molecular?
![]()
24.- A una determinada T y P ![]() tiene una
tiene una
densidad que es ![]() la de un gas
la de un gas
X. ¿Cuál es el peso molecular de X?
¿Cuál es la densidad de X a TPS?

25.- la composición del aire seco es
aproximadamente ![]() por ciento de
por ciento de
![]() ,
,
![]() por ciento de
por ciento de
![]() y
y
![]() por ciento de
por ciento de
![]() . Cuando la
. Cuando la
presión barométrica es ![]()
calcúlese la presión parcial ejercida por estos 3
componentes en el aire seco.
26.- Un matras de ![]() contiene
contiene
![]() y
y
![]() , a
, a
![]() .
.
¿Cuál es la presión total dentro del
matras?
Si se permite que la mezcla reaccione para formar
![]() (gaseosa) a la
(gaseosa) a la
misma temperatura ¿Qué materiales sobraran y cuales
serán sus presiones parciales parciales?
27.- ¿Cuál tendrá el valor de
![]() mas grande,
mas grande,
![]() ó
ó
![]() ?
?
Explíquese.
R= ![]() tiene
tiene
![]() rotacionales
rotacionales
de libertad
extra
28.- ¿Cuántas calorías se requieren
para elevar la temperatura de ![]() gaseoso desde
gaseoso desde
![]() hasta
hasta
![]() , con el
, con el
volumen constante?
29.- Para elevar en ![]() la temperatura
la temperatura
de ![]() TPS de un gas
TPS de un gas
desconocido se requiere ![]()
calcúlese ![]() para el gas.
para el gas.
¿Qué puede deducirse acerca de su estructura?
30.- Una mezcla de gases consiste
en ![]() por ciento de
por ciento de
![]() y
y
![]() por ciento de
por ciento de
![]() .
.
Calcúlese ![]() para esta
para esta
mezcla ¿Cuál es el peso molecular promedio de la
mezcla?
31.- A temperatura ambiente ![]() gaseoso tiene
gaseoso tiene
un ![]() excesivamente
excesivamente
superior a ![]() .
.
¿Cómo puede explicarse este comportamiento?
32.- A ![]() TPS de
TPS de
![]() gaseoso
gaseoso
encerrado en un recipiente rígido, se le adiciona
![]() de
de
energía calorífica. Calcúlese la temperatura
y la presión final del gas.
33.- ¿Cuánto calor deberá quitarse
![]() de gas
de gas
![]() contenido en
contenido en
un matraz de vidrio
(inicialmente a ![]() ) para reducir
) para reducir
su temperatura a ![]() ?
?
34.- Cuando se permite que se expansione un gas dejando
que mueva lentamente el pistón que lo encierra, se ha
encontrado que el gas se enfría. a) Explíquese por
que esto debería ser esperado. b) Sobre la base de esta
observación explíquese si se
necesitaría o no más o menos calor para elevar la
temperatura de ![]() de gas
de gas
![]() en
en
![]() si el proceso se
si el proceso se
conduce a volumen constante ![]() o a
o a
presión constante. NOTA: La cantidad de calor requerida
para cambiar la temperatura de ![]() de gas en
de gas en
![]() bajo
bajo
condiciones tales que la presión se mantiene constante
![]() .
.
35.- En un matras hay ![]() puro y en
puro y en
estado gaseoso la temperatura es ![]()
![]() y la
y la
presión ![]() . A
. A
![]() se a disociado
se a disociado
totalmente en ![]() .
.
Calcúlese la presión en el matras a
![]() .
.
36.- En un matras a ![]() hay
hay
![]() de
de
presión ejercida por ![]() y
y
![]() ejercida por
ejercida por
cloro. A temperaturas inferiores a ![]() estos dos
estos dos
reaccionan entre si totalmente para producir ![]() .
.
Calcúlese la presión final en este matras a
![]() .
.
¿Qué especies químicas estarán
presentes?
37.- Un matras de ![]() contiene a
contiene a
![]() cantidades
cantidades
equimoleculares de ![]() gaseoso y
gaseoso y
![]() gaseoso. Si la
gaseoso. Si la
masa total del gas en el matras es de ![]()
calcúlese la presión total.
CAPITULO VII
El
concepto del
poder de combinación – valencia
1.- ![]() de un elemento
de un elemento
X se combina para formar ![]() de un
de un
oxido ¿Cuál es el peso equivalente de X?

Peso equivalente de ![]()
2.- Al calentar ![]() un
un
oxido metálico, se descompuso dando el metal puro y
![]() TPS de
TPS de
![]()
¿Cuál es peso equivalente de X?

Peso equivalente de ![]()
3.- ![]() de
de
Níquel (valencia =2) se combina con un elemento X para
formar ![]() de un
de un
compuesto ¿Cuál es el peso equivalente de
X?
![]()
4.- Utilizando la tabla de pesos atómicos y valencias
conocidas, hágase las conversiones siguientes:
a)![]() de
de
![]() en
en
equivalentes
![]()
b)![]() en
en
equivalente
![]()
c)![]() de
de
![]() en
en
miliequivalentes
![]()
d)![]() en
en
equivalentes
![]()
e)![]() TPS de
TPS de
![]() gaseoso en
gaseoso en
equivalente
![]()
f)![]() en
en
![]()
![]()
g)![]() en
en
![]()
![]()
h)![]() en
en
![]()
![]()
i)![]() TPS de gas
TPS de gas
oxigeno ![]() en
en
![]() TPS
TPS

j)![]() de gas
de gas
![]() en
en
![]() TPS
TPS

5.-Utilizando el principio de equivalencia, calcular (sin
ecuaciones
químicas.
¿Cuántos gramos de ![]() reaccionaran
reaccionaran
con ![]() para producir
para producir
![]() y
y
![]() ?
?
![]()
¿Cuántos gramos de ![]() reaccionaran
reaccionaran
con ![]() ?
?
![]()
¿cuantos gramos de ![]() pueden
pueden
prepararse a partir de ![]() por
por
reacción con ![]() ?
?
![]()
d) ¿Cuántos gramos de acido
sulfúrico ![]() se necesitan
se necesitan
para que reaccionen totalmente con ![]() ?
?
![]()
e) ¿Cuántos gramos de ![]() reaccionaran
reaccionaran
con![]() para producir
para producir
hidrogeno y
cincato de sodio?
![]()
6.-Para neutralizar ![]() de un acido
de un acido
desconocido X se requieren exactamente ![]() de acido
de acido
¿Cuál es el peso equivalente del acido?
![]()
7.-![]() neutralizaran
neutralizaran
exactamente ![]() de un acido
de un acido
¿cuál es el peso equivalente del acido?

8.-cuando ![]() de un
de un
acido desconocido reaccionen con Zinc metálico se
desprende exactamente ![]() TPS
TPS
de![]() gaseoso.
gaseoso.
¿Cuál es el peso equivalente del acido?

9.- Cuando reacciona con un acido ![]() de un metal
de un metal
desconocido se producen exactamente ![]() TPS de
TPS de
![]() gaseoso.
gaseoso.
¿Cuál es el peso equivalente del metal?
10.- Dada la valencia del oxigeno como 2, calcúlese la
valencia del otro elemento en cada uno de los siguientes
compuestos:
a)![]()
b)![]()
c)![]()
d)![]()
e)![]()
f)![]()
g)![]()
h)![]()
i)![]()
j)![]()
k)![]()
Autor:
Carlos A. Lozano E.
 Página anterior Página anterior |   Volver al principio del trabajo Volver al principio del trabajo | Página siguiente  |
