Guía de Química para el examen de ingreso a la UNAM (página 3)
La oxidación se define por lo tanto como el
aumento de valencia por la pérdida de electrones, y
por el contrario, la reducción es la disminución
de valencia por la ganancia de electrones. En una reacción
de oxido-reducción (redox), debe identificarse los
componentes que cambian su número de oxidación, es
decir, quien se oxida (agente reductor) o se reduce (agente
oxidante).
Balanceo de ecuaciones
El balanceo de una ecuación química, consiste, en realizar las
operaciones necesarias para
encontrar los coeficientes que permitan obtener la misma cantidad
de reactivos que de productos en una reacción
química. Para ajustar o balancear una reacción
química pueden seguirse los métodos del tanteo o
redox.
Balanceo por el método del tanteo.-
Considera una estimación de coeficientes por conteo directo
de los átomos de los reactivos y de los productos, para
posteriormente igualarlos mediante el empleo sucesivo de diferentes
coeficientes, hasta obtener la ecuación balanceada.
Ejemplo: Na + O2 –>
Na2 O
1. Contar el número de átomos de cada lado de la
reacción, observar que en el producto se carece de un
oxigeno, colocar el
coeficiente que iguale los valores
correspondientes.
Na + O2
–> 2Na2 O
2. Observar que en el producto, ahora existen 4 átomos de
sodio, por lo que se balancea con un coeficiente 4 en el
reactivo.
4Na +
O2 –>
2Na2 O
3.La ecuación está balanceada
Balanceo por el método de óxido-reducción
(redox).- Es aquel en el cual dentro de una reacción
química, algunos átomos cambian su número de
oxidación, al pasar de reactivos a productos, es decir, que
se oxidan o que se reducen. Para realizar este procedimiento, se requiere
cumplir con los siguientes criterios:
- Determinar los números de oxidación de todos y
cada uno de los elementos involucrados en de la ecuación
química. - Identificar los elementos que cambian su número de
oxidación y determinar la variación de los elementos
que se oxidaron y redujeron respectivamente. - Los valores de oxidación y reducción de esa
variación, corresponderán a los coeficientes de los
compuestos que contengan los elementos en forma inversa,
ejemplo:
Cl+5
–>Cl-1 +6
e- (oxida)
O-2
–>O0 –
2e- (reduce
4. Por último, se balancea por tanteo
Ejemplo:
Cu + HNO3–> Cu
(NO3)2 + H2O
+ NO
1) Determinar número de oxidación
Cu0 +
H+1N+5O3-2–>Cu
+2(NO3)2-1
+ H2+1 O-2
+ N+2 O-2
2) Indicar a los elementos que cambiaron su número de
oxidación
Cu0 –>
Cu
+2
+2 e- (se oxida) pierde electrones
N+5 –>
N+2
-3
e- (se reduce) gana electrones
3) Se multiplica por 3 a los reactivos y productos que tengan
cobre (Cu) y por 2 los que
contengan nitrógeno (N)
3Cu0 +
2H+1N+5O3-2
–> 3Cu
+2(NO3)2-1
+ H2+1 O-2
+ 2N+2 O-2
4) Observar que existen más nitrógenos en los
productos que en los reactivos, por lo que se balancea la
ecuación química "por tanteo"
3Cu0 +
8H+1N+5O3-2
–> 3Cu
+2(NO3)2-1
+ H2+1 O-2
+ 2N+2 O-2
5) Por último, se balancean los hidrógenos y
oxígenos por tanteo
3Cu0 +
8H+1N+5O3-2
–> 3Cu
+2(NO3)2-1
+ 4H2+1
O-2 + 2N+2
O-2
Estequiometría
La estequiometría (del
griego stoicheion "elemento" y metron "medida") se
basa en el entendimiento de las masas atómicas y en un
principio fundamental la ley de la conservación de la
masa: La masa total de todas las masas presentes
después de una reacción química es la misma que la
masa total antes de la reacción. [Lavoasier;
Antoine.]
Bases de la Estequiometría
Las unidades utilizadas en química para expresar la masa,
el volumen, la temperatura y la relación
que guardan entre ellas en una reacción química son
conocidas como unidades químicas
El siguiente esquema presenta 3 unidades químicas que a
continuación se definen

-
Número Atómico: Es el número de protones y
se indica con un subíndice al lado del símbolo
atómico
-
Peso atómico: Es el número total de protones y
neutrones en el núcleo y se indica con un superíndice
al lado del símbolo atómico.
-
Isótopo: Son átomos de un elemento dado que
difieren en el número de neutrones y por lo tanto en su
masa.
-
Peso Molecular: También conocido como peso
fórmula. Es la suma de los pesos atómicos de los
átomos de su fórmula química.
Peso molecular (peso fórmula) del ácido
sulfúrico (H2SO4)
2 átomos de H | Peso de H: 1 uma | 2(1 uma)= | 2 uma |
1 átomo de S | Peso de S: 32 uma | 1(32 uma)= | 32 uma |
4 átomos de O | Peso de O: 16 uma | 4(16 uma)= | 64 uma |
|
|
| 98 uma |
El concepto de mol
En química, la unidad para manejar el número de
átomos, iones y moléculas en una muestra de tamaño ordinario
es el mol; cuya abreviatura es también el mol. Un
mol es la cantidad de materia que contiene tantos
objetos (sean átomos, moléculas o cualquier otro tipo
de objetos que estemos considerando) como átomos hay
exactamente en 12 g de 12C. Mediante experimentos, los
científicos han determinado que este número es
6.0221421 x 1023. Este número se conoce como
número de Avogadro, en honor a Amadeo Avogadro. En
realidad se utiliza una aproximación del número que
suele ser 6.02 x 1023
Tabla 1: Mol y Número de
Avogadro
1 mol de átomos de | = | 6.02 x 1023 átomos de |
1 mol de moléculas de | = | 6.02 x 1023 moléculas de |
1 mol de iones de | = | 6.02 x 1023 iones de NO3 |
Un mol de átomos, un mol de moléculas
o un mol de cualquier objeto
Masa molar
Una docena siempre es el número 12, sea que se hable de
una docena de huevos o de una docena de elefantes. No obstante,
es obvio que una docena de huevos no tiene la misma masa que una
de elefantes. De manera análoga, un mol siempre es el mismo
número (6.02 x 1023), pero un mol de una
sustancia y un mol de otra sustancia distinta tienen diferente
masa. Ahora bien, puede usarse las masas atómicas de los
elementos para encontrar la masa de un mol de cualquier
sustancia, a este valor se le conoce como
masa molar. Supóngase que se desea encontrar las
masas molares del carbono (C) y del cobre (Cu).
Dicho de otra manera, se desea conocer la masa de un mol de
átomos de C y un mol de átomos de Cu (6.02 x
1023 átomos en los dos casos). Se busca las
masas atómicas de estos elementos en la tabla
periódica: La masa atómica del carbono es 12.01; la del
cobre es 63.55. Se agrega, simplemente, unidades "gramos" (g) a
estos valores.
1 mol de C = 12.01 g 1 mol de Cu = 63.55 g
En resumen, la masa (en gramos) de un mol de átomos de
un elemento es igual al valor numérico de la masa
atómica del elemento. En caso de tener un compuesto se
aplica una regla similar, la masa (en gramos) de cualquier
sustancia o compuesto siempre es numéricamente igual a su
peso fórmula (en uma)
Concentración de las disoluciones
Tomando en cuenta la cantidad de soluto que se disuelve o que
toma parte en la disolución, puede clasificarse en:
- Disoluciones diluidas: Aquellas que tienen muy poca
cantidad de soluto. - Disoluciones concentradas: Aquellas que tienen una gran
cantidad de soluto. - Disoluciones saturadas: Aquellas en las que está
disuelta la mayor cantidad posible de soluto a cierta
temperatura. - Disoluciones sobresaturadas: Las que tienen una
proporción de soluto mayor de las que corresponde al
equilibrio de saturación a la misma temperatura.
Es importante señalar que una solución saturada no
es necesariamente concentrada. Por ejemplo, cuando el
CaCO3 permanece en contacto con cierta cantidad de
agua hasta que se alcanza un
equilibrio entre el carbonato
disuelto y el que está sin disolver, la solución
saturada es extremadamente diluida, pues el carbonato de calcio
es muy poco soluble.
Porcentaje por masa
El porcentaje por masa de un soluto en una solución,
significa las partes en masa del soluto en 100 partes de
solución:
![]()
Ejemplos:
Una solución al 15% de cloruro de magnesio en agua,
contiene, 15g de soluto y 85g de disolvente para formar 100g de
solución.
![]()
¿Cuál es el tanto por ciento en masa de una
solución que contiene 15g de cloruro de sodio en la
suficiente agua, para obtener 165g de solución?
![]()
¿Cuántos gramos de nitrato de plata se requieren
para preparar 400g de una solución al 5%?
![]()
Molalidad
La molalidad (m) se define como el número de moles de
soluto sobre kilogramo de disolvente. Este método para
expresar la concentración está basado en la masa de
soluto (en moles) por unidad de masa (en Kg.) de disolvente.
![]()
Ejemplos:
Una solución de 1m de cloruro de magnesio se prepara al
disolver 95g de cloruro de magnesio en un kilogramo de agua.
![]()
Calcular la molalidad de una solución de ácido
fosfórico, que contiene 32.7g en 100g de agua
![]()
Molaridad
La molaridad (M) se define como el número de moles de
soluto sobre un litro de solución
![]()
Este método de expresar la concentración, es
útil cuando se emplean equipos volumétricos (probetas,
buretas, etc.) con el fin de medir una cantidad de solución.
A partir del volumen medido, un cálculo simple permite
determinar la masa del soluto empleado.
Ejemplos:
Calcular la molaridad de una solución de NaOH, que
contiene 20g en .51 de solución.
![]()
Calcular la cantidad de litros de solución 6M de
ácido sulfúrico que se requieren para contener 300g de
este ácido
![]()
Normalidad
La normalidad (N) se define como el número de
equivalentes de soluto sobre un litro de solución
![]()
La masa equivalente en gramos (1 equivalente) de un
ácido, se determina dividiendo la masa fórmula gramo
del ácido, entre el número de iones H+
sustituibles que contenga la fórmula.
![]()
![]()
La masa equivalente en gramos (1 equivalente) de una base, se
determina dividiendo la masa fórmula gramo de la base, entre
el número de oxhidrilos sustituibles que contenga la
fórmula.
![]()
![]()
La masa equivalente en gramos (1 equivalente) de una sal, se
determina dividiendo la masa fórmula gramo de la sal, entre
la valencia total de los cationes (número de moles de cargas
positivas) que contenga la fórmula.
![]()
![]()
Ejemplos:
Calcular la normalidad de una solución de ácido
fosfórico que contiene 28.4g de soluto en un litro de
solución
![]()
Calcular los gramos de H2SO4 que se
necesitan para preparar 500ml de una solución .1N
![]()
Ácidos y
bases
Teoría de Arrhenius.- Ácido es toda sustancia
que al estar en solución acuosa produce iones hidrógeno
(H+), o bien, iones hidronio (H3O+)
y una base como toda sustancia que al estar en solución
acuosa produce iones oxhidrilo (OH-)
Ácido
HCl(aq)
<—-> H+(aq)
+ Cl-(aq)
Base
NaOH(aq)
<—->
Na+(aq) + OH-(aq)
Teoría de Browsted- Lowry.- Explica que en las
reacciones ácido-base existe una transferencia de protones,
cuando el ácido dona un protón, el ión negativo
producido en la reacción se convierte en una base, o
viceversa, la base, aceptando un protón, llega a ser
un ácido. Así mismo, al hacer reaccionar una base con
un ácido en la misma cantidad se neutralizan.
Teoría de Lewis.- Los compuestos moleculares no
iónicos se originan por la compartición de electrones
entre átomos. El enlace formado al producirse un
compuesto molecular, implica la existencia de un par de
electrones compartidos entre dos átomos.
Características de los ácidos y bases en soluciones acuosas
Ácidos: ceden protones, tienen sabor agrio,
tiñen de rojo el papel tornasol, tienen un pH de 1-6, reaccionan con los
metales formando sales y
desprendiendo hidrógeno y con los hidróxidos forman
sales neutras.
2HF + 2Na –> H2 + 2NaF
ácido
metal
sal
Na(OH) + HNO3 –>
NaNO3 + H2O
Base
ácido
sal
agua
Características de las bases
Ganan protones de los ácidos, tienen sabor amargo,
tiñen de azul el papel tornasol rojo, su pH es de 8-14,
tienen consistencia jabonosa, neutraliza loa ácidos.
Potencial de Hidrógeno o pH
Es la concentración de iones de H+ del agua pura. Se
expresa de la siguiente manera:
PH = -log (H3O+) o
-log(H+)
El agua tiene un pH = 7(neutra)
Escala del pH: Explica los valores del pH de distintas
sustancias.

Ácido fuerte: pH
bajo
Base fuerte: pH
alto
Ácido débil: pH alto
Base
débil: pH bajo
Solución neutra H+
y OH- equilibrados.
Solución
ácida H+ predomina
Solución
básica OH- predomina
Química del
Carbono
Estructura molecular de los compuestos del carbono
Introducción a la química orgánica
Los compuestos orgánicos como
los inorgánicos, son de excepcional importancia para los
organismos vivos, como integradores del medio ambiente en que viven, o
como formadores del medio interno que les proporciona turgencia y
su misma arquitectura, constituyendo ese
complejo que en algún tiempo se atribuyó a la
"fuerza vital".
Desde el siglo XVII se dividió el estudio de la
química en inorgánica o anorgánica y
orgánica, con el objeto de distinguirlas y facilitar su
estudio dentro del medio natural.
La química orgánica es el estudio de los compuestos
del carbono en cuanto a su composición, propiedades,
obtención, transformaciones y usos. Comprende un amplio
campo de estudio en la tecnología de productos como
colorantes, drogas, azúcares,
proteínas, grasas, insecticidas,
fungicidas, combustibles, licores, cosméticos, hormonas, medicamentos,
aromatizantes, fibras textiles, etc. Anteriormente, dichos
productos se aislaban de fuentes animales o vegetales y por eso se
les dio el nombre de orgánicos, es decir sintetizados por
los seres vivos, en la actualidad se producen en el laboratorio y se conocen
más de 7 millones de compuestos orgánicos diferentes,
mientras que inorgánicos sólo hay 300,000 compuestos
(Ocampo, et al., 1999). La química orgánica o
química del carbono -como también se le denomina- por
ser el carbono el elemento esencial de estos compuestos- estudia
al conjunto de sustancias cuyos elementos fundamentales e
irremplazables son el carbono, el hidrógeno y el oxígeno, e
indispensables, el nitrógeno, el fósforo y el azufre.
Con menor frecuencia entran en su composición los
halógenos y otros elementos como el magnesio, el sodio, el
potasio, el fierro, etcétera (Llera, 1984).
Diferencia entre compuestos orgánicos e
inorgánicos.
En 1828, Federico Wóehler, preparo en su laboratorio una
cantidad del compuesto inestable conocido con el nombre de
Cianato de Amonio; esta sustancia fue calentada y con gran
sorpresa notó que se había transformado en unos
cristales blancos y sedosos. Rápidamente hizo unas pruebas: eran cristales de
Urea, la sustancia que se obtiene cuando se evapora la orina.
Para Wóehler éste fue un cambio de lo más
sorprendente y enigmático, porque el Cianato de Amonio era
un compuesto inorgánico que podía prepararse en el
laboratorio; mientras que la Urea era un compuesto orgánico,
producto de la actividad de un organismo vivo, la cual, de
acuerdo con las teorías de la época,
sólo podía prepararse por medio de los procesos de los organismos
vivos. Sin embargo Wóehler la había preparado en un
tubo de ensayo. Estos compuestos son
idénticos a los inorgánicos o minerales y en su formación
se cumplen las mismas leyes. La barrera que separaba al
mundo inorgánico del mundo orgánico fue eliminada con
estos descubrimientos. Es de preguntarse por qué en la
actualidad se conserva la Química en dos secciones:
Inorgánica y Orgánica, siendo que han desaparecido las
diferencias de origen que entre ellas se hicieron. Algunas de las
razones que se tienen para conservar la anterior división
son las siguientes:
Diferencias entre compuestos orgánicos
e inorgánicos
| Orgánicos | Inorgánicos |
Tipo de enlace | Predomina el enlace covalente | Predomina el enlace iónico |
Solubilidad | Son solubles en solventes no | Por lo general son solubles en agua |
Puntos de fusión y | Bajos puntos de fusión y | Presentan altos puntos de fusión y |
Velocidad de reacción | Por lo general, las reacciones son | Las reacciones son casi |
Estructuras | Forman estructuras complejas, | No forman estructuras complejas y sus |
Isomería | Fenómeno frecuente | Fenómeno poco frecuente. |
Tipos de fórmulas en química orgánica
(condensada, semidesarrollada y desarrollada)
De acuerdo a la tetravalencia del carbono, los compuestos
orgánicos se pueden representar mediante tres tipos de
fórmulas:
- Condensada o molecular.- La fórmula condensada
es la que expresa en forma sintetizada los átomos que
intervienen en el compuesto. - Semidesarrollada o de estructura.- La fórmula
semidesarrollada como su nombre lo indica en parte es
condensada y en parte es desarrollada, utiliza una raya para
representar el enlace covalente que se forma entre los
átomos de carbono. - Desarrollada o gráfica. La fórmula
desarrollada es la que nos indica el enlace entre todos
los átomos que forman la molécula del compuesto
usando una raya para representarlos.
De estas fórmulas la más conveniente para
representar las moléculas de los compuestos es la
semidesarrollada, por que la condensada se presta a
isomerías, es decir a moléculas que teniendo el mismo
número y tipo de átomos varían en su estructura y por consiguiente
en sus propiedades; la desarrollada es muy laboriosa
Ejemplos de tipos de fórmulas
Condensada | Semidesarollada | Desarrollada |
C2H6 | CH3 – CH3 |
|
C3H8 | CH3 – CH2 – |
|
Tipos de cadenas
El carbono con sus cuatro valencias, carece de tendencia para
ganar o perder electrones y le es difícil adquirir cargas
positiva o negativa. Está considerado dentro del grupo de los elementos
más combinables, pudiéndolo hacer entre sí y
formar largas cadenas, utilizando entre carbono y carbono una,
dos o tres valencias, o bien cerrar las cadenas para estructurar
cadenas cíclicas.
Por todas estas características, al combinarse entre
sí, forma cadenas lineales o abiertas con ramificaciones
llamadas arborescencias o sin ellas, con una, dos o tres
ligaduras entre carbono y carbono. Estas cadenas son las que
constituyen lo que se llama el "esqueleto" de los compuestos
orgánicos "acíclicos", para diferenciarlos de los
"cíclicos" o de cadena cerrada, cuyos eslabones forman
ciclos que pueden estar cerrados por un carbono u otro elemento
diferente.
Hidrocarburos
Son compuestos constituidos exclusivamente por carbono e
hidrógeno.
Pueden ser:
a)
Acíclicos: Son hidrocarburos de cadenas
carbonadas abiertas. Existen dos tipos de cadenas abiertas:
-
Cadenas lineales: los átomos de carbono pueden
escribirse en línea recta.
Ejemplo:
![]()
-
Cadenas ramificadas: están constituidas por
dos o más cadenas lineales enlazadas. La cadena lineal
más importante se denomina cadena principal; las
cadenas que se enlazan con ella se llaman radicales.
Ejemplo:

b)
Cíclicos: Son
hidrocarburos de cadenas carbonadas cerradas, formadas al unirse
dos átomos terminales de una cadena lineal. Las cadenas
carbonadas cerradas reciben el nombre de ciclos.
Ejemplo:

Existen hidrocarburos policíclicos, constituidos por
varios ciclos unidos entre sí.
Ejemplo:

En el cuadro de la página anterior se encuentran
clasificados los hidrocarburos en función del tipo de enlace
que tienen: simple, doble o
triple. Los hidrocarburos correspondientes se
llaman, respectivamente, alcanos,
alquenos y alquinos.
HIDROCARBUROS SATURADOS, PARAFINAS O ALCANOS
Se llaman hidrocarburos saturados o alcanos los
compuestos constituidos por carbono e hidrógeno, que son de
cadena abierta y tienen enlaces simples.
Alcanos de cadena lineal
Su fórmula empírica es CnH2n+2, siendo n el
número de átomos de carbono. Forman series
homólogas, conjuntos de compuestos con
propiedades químicas similares y que difieren en el
número de átomos de carbono de la cadena.
Ejemplo:

Según las normas IUPAC, para nombrar los
alcanos lineales se consideran
dos casos:
1. Los cuatro primeros compuestos
reciben los nombres siguientes:
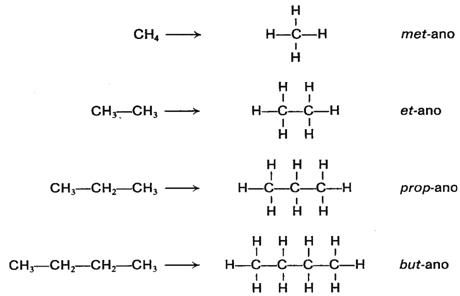
2. Los compuestos siguientes se
nombran utilizando como prefijos los numerales griegos que
indican el número de átomos de carbono de la cadena,
añadiéndoles la terminación ano, que
es genérica y aplicada a todos los hidrocarburos saturados
(de ahí el nombre de alcanos).
Ejemplos:

Los compuestos siguientes de la serie se llaman tetradecano
(14), pentadecano (15), hexadecano (16), heptadecano (17),
octadecano (18), nonadecano (19), eicosano (20), eneicosano (21),
docosano (22), tricosano (23), tetracosano (24)…, triacontano
(30)…, tetracontano (40), etc.
Isomería
Se presenta cuando dos compuestos tienen el mismo número
de átomos de CnHn, pero
presenta estructuras internas o configuración del esqueleto
diferentes. Ejemplo: C4H10
![]() Butano CH3 –
Butano CH3 –
CH2 – CH2 –
CH3
Isobutano o 2, metil propano CH3 –
CH2 – CH3
CH3
Isomería de lugar:
Se da en el enlace doble y triple. Ejemplo:
C5H10
CH3 – CH2 – CH2 – CH =
CH2
CH3 – CH2 – CH = CH – CH3
1
penteno
2 penteno
HIDROCARBUROS CON DOBLES ENLACES, OLEFINAS O
ALQUENOS
Son hidrocarburos que presentan uno o más dobles
enlaces entre los átomos de carbono. La fórmula
general, para compuestos con un solo doble enlace, es
CnH2n.
Ejemplo:
![]()
Alquenos con un solo doble enlace
Se nombran según las siguientes normas:
- Se
elige la cadena más larga que contiene al doble enlace y se
sustituye la terminación ano por
eno.
- Se
numera la cadena a partir del extremo más próximo al
doble enlace. El localizador de éste es el menor de los dos
números que corresponden a los dos átomos de carbono
unidos por el doble enlace.
- La
posición del doble enlace o instauración se indica
mediante el localizador correspondiente que se
coloca delante del nombre.
Ejemplo:

- Si hay
radicales, se toma como cadena principal la cadena más
larga de las que contienen el doble enlace.
La numeración se realiza de tal modo que al átomo de
carbono con doble enlace le corresponda el localizador más
bajo posible. Los radicales se nombran como en los alcanos.
Alquenos con un solo doble enlace
Se nombran según las siguientes normas:
- Se
elige la cadena más larga que contiene al doble enlace y se
sustituye la terminación ano por
eno.
- Se
numera la cadena a partir del extremo más próximo al
doble enlace. El localizador de éste es el menor de los dos
números que corresponden a los dos átomos de carbono
unidos por el doble enlace.
- La
posición del doble enlace o instauración se indica
mediante el localizador correspondiente que se
coloca delante del nombre.
Ejemplo:

- Si hay
radicales, se toma como cadena principal la cadena más
larga de las que contienen el doble enlace.
La numeración se realiza de tal modo que al átomo de
carbono con doble enlace le corresponda el localizador más
bajo posible. Los radicales se nombran como en los alcanos.
Alquenos con varios dobles enlaces
- Cuando
un hidrocarburo contiene más de un doble enlace, se utilizan
para nombrarlo las terminaciones: -adieno,
-atrieno, etc., en lugar de la terminación
eno*. Se numera la cadena asignando a los carbonos con
doble enlace los localizadores más bajos que se pueda.
Ejemplo:

- Si el
compuesto contiene radicales, estos se nombran como en los
alcanos, eligiendo como cadena principal del hidrocarburo la que
contenga el mayor número de dobles enlaces,
aunque no sea la más larga.
Ejemplos:

Las verdaderas terminaciones son -dieno, -trieno, etc. Se
incluye en ellas la letra "a" para evitar nombres de
fonética desagradable.

HIDROCARBUROS CON TRIPLES ENLACES, ACETILENOS O
ALQUINOS
Son hidrocarburos que presentan uno o más
triples enlaces entre los átomos decarbono. La
fórmula general, para compuestos con un sólo triple
enlace, es CnH2n-2.
Ejemplo:
![]()
Alquinos con un solo triple enlace
Se nombran de acuerdo con las siguientes normas:
- Se
elige la cadena más larga del hidrocarburo que contiene el
triple enlace y se coloca la terminación
ino.
- Se
numera la cadena a partir el extremo más próximo al
triple enlace.
- La
posición de éste se indica mediante el
localizador correspondiente, que será el menor
de los dos números asignados a los dos átomos de
carbono unidos por el triple enlace. El localizador se coloca
delante del nombre.
Ejemplo:

- Si hay
radicales, se toma como cadena principal la cadena más
larga que contenga el triple enlace. La
numeración se realiza de modo que corresponda al átomo
de carbono con triple enlace el localizador más bajo
posible. Los radicales se nombran como en los alcanos.
Ejemplos:

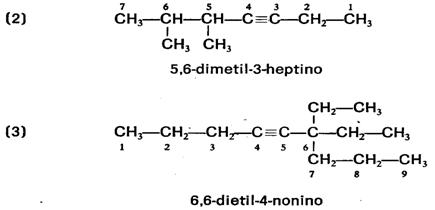
HIDROCARBUROS CÍCLICOS
Son hidrocarburos de cadena cerrada. Según tengan o no
instauraciones, se clasifican en:
-
Hidrocarburos monocíclicos saturados
(cicloalcanos).
-
Hidrocarburos monocíclicos no saturados
(cicloalquenos y cicloalquinos).
Hidrocarburos monocíclicos no saturados
Los átomos de carbono del hidrocarburo cíclico
están unidos por enlaces sencillos. Responden a la
fórmula general CnH2n. Se nombran anteponiendo el
prefijo ciclo al nombre del alcano de cadena
abierta de igual número de átomos de carbono.
Ejemplos:

También se representan así:

HIDROCARBUROS AROMÁTICOS
Son compuestos cíclicos que guardan estrecha
relación con el benceno (C6H6). Recibieron este
nombre porque la gran mayoría de ellos poseen olores fuertes
y penetrantes. En la actualidad, el término
aromático expresa que el compuesto es más
estable de lo esperado, es decir, menos reactivo. El nombre
genérico de los hidrocarburos aromáticos es
areno y los radicales derivados de ellos se llaman
arilo. El benceno es la base de estos compuestos;
su fórmula se expresa de uno de estos tres modos:
|
|
• Los compuestos aromáticos que tienen
sustituyentes se nombran anteponiendo los nombres de los
radicales a la palabra benceno.
Ejemplos:

• Cuando hay dos sustituyentes, su posición
relativa se indica mediante los números 1,2 , 1,3 y 1,4 , o
mediante los prefijos orto (o), meta
(m) y para (p), respectivamente.
Ejemplos:

Alcoholes y
fenoles
Los alcoholes pueden considerarse
derivados de los hidrocarburos al sustituir un átomo de
hidrógeno por el grupo -OH (hidroxilo).
- Si el
hidrocarburo es alifático, da lugar a los
alcoholes. Ejemplo:

- Si el
hidrocarburo es aromático, se obtienen los
fenoles. En sentido estricto, el
fenol debería llamarse bencenol.
Ejemplo:

ALCOHOLES
El grupo funcional es el -OH (hidroxilo). La fórmula
general es R-OH. El radical R procede de un hidrocarburo
alifático. Puede ser radical alquilo, alquenilo o alquinilo.
La fórmula general para un alcohol saturado con un solo
grupo hidroxilo es CnH2n+1OH. Pueden existir alcoholes con
varios grupos hidroxilo: son los
polialcoholes.
Alcoholes con un solo grupo funcional
Estos alcoholes pueden ser primarios,
secundarios o terciarios, según
esté unido el grupo funcional (-OH)a un carbono primario,
secundario o terciario[1]. Para
nombrar los alcoholes se considera que se ha sustituído un
átomo de hidrógeno de un hidrocarburo por un radical
-OH, el alcohol así obtenido se nombra añadiendo la
terminación ol al hidrocarburo de que procede.
Ejemplo:

Si el alcohol es secundario o terciario, se numera la cadena
principal de tal modo que corresponda al carbono unido al radical
-OH el localizador más bajo posible.
La función alcohol tiene preferencia al
numerar sobre las instauraciones y sobre los
radicales.
Ejemplos:

Los
aldehídos
Los aldehídos son cada uno de los compuestos
orgánicos que contienen el grupo carbonilo (CO) y que
responden a la fórmula general
![]()
Donde R es un átomo de hidrógeno (es el caso del
metanal) o un radical hidrocarbonado alifático o
aromático.
Los aldehídos son aquellos compuestos caracterizados por
la presencia de uno o más grupos carbonilo en posición
terminal. La cadena principal debe contener al carbono del grupo
carbonilo. Si hay dos grupos carbonilos, la cadena principal
deberá contener a ambos. Se le dará el numero uno al
carbono del grupo carbonilo. El sufijo a utilizar es al, o
dial si hubiera dos grupos carbonilo, uno al principio y
otro al final de la cadena carbonada.
Nomenclatura de los aldehídos.
Para nombrar a los aldehídos se cambia la
terminación o de los alcanos por al para denotar la
presencia de un aldehído. El grupo carbonilo de los
alcanales o aldehídos siempre está al final de la
cadena. Este hecho lo hace química y físicamente
diferente a las cetonas, por eso se considera como un grupo
funcional aparte El hidrógeno vecino al oxígeno es
fácilmente oxidable y esta es una de las principales
diferencias entre estas dos familias de compuestos Como
este grupo funcional siempre está al final de la cadena no
se usan números localizadores.
Propiedades físicas.
No es de sorprender que los aldehídos y las cetonas se
asemejen en la mayoría de sus propiedades como consecuencia
de poseer el grupo carbonilo. Sin embargo, en los aldehídos
el grupo carbonilo esta unido a un átomo de hidrógeno,
mientras que en las cetonas se une a dos grupos orgánicos.
Esta diferencia estructural afecta a sus propiedades de dos
formas fundamentales: Los aldehídos se oxidan con
facilidad mientras que las cetonas lo hacen con dificultad Los
aldehídos suelen ser más reactivos que las cetonas en
adiciones nucleofílicas, que es la reacción más
característica de este tipo de compuestos.
Los aldehídos son compuestos de fórmula general
R-CHO. Este compuesto tiene una amplia aplicación tanto como
reactivos y disolventes así como su empleo en la
fabricación de telas, perfumes, plásticos y medicinas. En la
naturaleza se encuentran
ampliamente distribuidos como proteínas, carbohidratos y ácidos
nucleicos tanto en el reino animal como vegetal, controlando el
proceso para evitar que el
aldehído pase a ácido.
Cetonas
Son cada uno de los compuestos orgánicos que contienen el
grupo carbonilo (CO) y que responden a la fórmula general
R"CO"Ró, en la que R y Ró representan radicales
orgánicos y donde los grupos R y R´ pueden ser
alifáticos o aromáticos.
Nomenclatura de las cetonas
Para nombrar las cetonas tenemos dos alternativas:
- El
nombre del hidrocarburo del que procede terminado en -ona .Como
sustituyente debe emplearse el prefijo oxo-.
- Citar
los dos radicales que están unidos al grupo carbonilo por
orden alfabético y a continuación la palabra
cetona.

Propiedades físicas
Los compuestos carbonílicos presentan puntos de
ebullición más bajos que los alcoholes de su mismo peso
molecular .No hay grandes diferencias entre los puntos de
ebullición de aldehídos y cetonas de igual peso
molecular. Los compuestos carbonílicos de cadena corta son
solubles en agua y a medida que aumenta la longitud de la cadena
disminuye la solubilidad.
El grupo funcional de las cetonas es:
R
|
C=O
|
' R
Al grupo carbonilo se debe la disolución de las cetonas
en agua. Son compuestos relativamente reactivos, y por eso
resultan muy útiles para sintetizar otros compuestos;
también son productos intermedios importantes en el metabolismo de las células. Se obtienen a
partir de los alcoholes secundarios.
La cetona más simple, la propanona o acetona, CH3COCH3,
es un producto del metabolismo de las grasas, pero en condiciones
normales se oxida rápidamente a agua y dióxido de
carbono. Sin embargo, en la diabetes mellitus la propanona se
acumula en el cuerpo y puede ser detectada en la orina. Otras
cetonas son el alcanfor, muchos de los esteroides, y algunas
fragancias y azúcares.
éteres.
Los éteres poseen un átomo de oxígeno unido a
dos cadenas alquílicas que pueden ser iguales o diferentes.
El más conocido es el éter dietílico que se
empleaba como agente anestésico en operaciones
quirúrgicas.
![]()
Los éteres se nombran colocando el nombre de las dos
cadenas alquílicas que se encuentran unidas al átomo de
oxígeno, una a continuación de la otra, y, finalmente,
se añade la palabra éter.

Aminas
Son compuestos que poseen el grupo amino en su estructura. Se
consideran compuestos derivados del amoníaco, por tanto,
presentan propiedades básicas. También pueden
clasificarse como primarias, secundarias o terciarias, según
el grado de sustitución del átomo de
nitrógeno.

Tradicionalmente las aminas se nombran colocando los nombres
de los radicales en orden alfabético seguido de la
terminación AMINA.

En la actualidad se emplea otro sistema para nombrar a las
aminas. Este sistema consiste en:
1. Identificar la cadena principal
como aquella que contiene mayor número de átomos de
carbono y además contiene el grupo amino.
2. Colocar la terminación AMINA
al final del nombre del hidrocarburo que constituye el esqueleto
de la cadena principal.
3. Para localizar el grupo amino
dentro de la cadena principal se utiliza el número del
carbono que está unido directamente al nitrógeno y este
número o localizador se coloca delante del nombre de la
terminación AMINA.
4. Si la amina es secundaria o
terciaria, se dan los nombres de los radicales alquilo que
están unidos al nitrógeno precedidos de la letra N en
cursiva para indicar que dichos grupos están unidos al
nitrógeno y no a un carbono

Ácidos
carboxílicos
Estos compuestos se caracterizan por poseer en su estructura
al grupo funcional carboxilo (-COOH). Muchos ácidos
carboxílicos simples reciben nombres no sistemáticos
que hacen referencia a las fuentes naturales de las cuales
proceden. Por ejemplo, el ácido fórmico se llama
así porque se aisló por primera vez de las hormigas
(formica en latín). El ácido acético, que se
encuentra en el vinagre, toma su nombre de la palabra acetum,
"ácido". El ácido propiónico da el aroma
penetrante a algunos quesos y el ácido butírico es el
responsable del olor repulsivo de la mantequilla rancia.

Al igual que los aldehídos y cetonas, los ácidos
carboxílicos de bajo peso molecular son muy polares y, por
tanto, muy solubles en agua. El grupo ácido (-COOH) se halla
siempre en uno o ambos extremos de la cadena y se nombran con la
terminación -OICO.
![]()
ésteres.
Los esteres se consideran como el resultado de la
condensación entre un ácido carboxílico y un
alcohol. Los ésteres de bajo peso molecular, como el acetato
de butilo (CH3COOBu) y el acetato etilo
(CH3COOEt) se emplean como disolventes industriales,
especialmente en la preparación de barnices.

El olor y sabor de muchas frutas se debe a la presencia de
mezclas de ésteres. Por
ejemplo, el olor del acetato de isoamilo recuerda al de los
plátanos, el propionato de isobutilo al del ron, etc.

Se nombran de la siguiente manera: nombre del ácido del
que deriva con la terminación -ato de + nombre del radical
que sustituye al H del ácido correspondiente con la
terminación -ilo

Amidas.
Las amidas se pueden obtener por reacción entre un
ácido carboxílico y una amina, que puede ser primaria o
secundaria. La estructura de algunas amidas simples, como la
acetamida y la propanamida, se indica a continuación

Se nombran cambiando la terminación -o del hidrocarburo
correspondiente por la terminación -AMIDA
Macromoléculas
Las macromoléculas son moléculas que tienen
una masa molecular elevada, formada por un gran número de
átomos. Generalmente podemos describirlas como la
repetición de una o unas pocas unidades mínimas
(monómeros), formando los polímeros. A menudo el
término macromolécula se refiere a las moléculas
que contienen más de 100 átomos. Pueden ser tanto
orgánicas como inorgánicas, y se encuentran algunas de
gran relevancia en el campo de la bioquímica, al estudiar las
biomoléculas. Dentro de las moléculas orgánicas
sintéticas encontramos a los plásticos.
Carbohidratos
Son una clase básica de
compuestos químicos en bioquímica. Son la forma
biológica primaria de almacén o consumo de energía; otras
formas son las grasas y las proteínas. Están compuestas
en su mayor parte por átomos de carbono, hidrógeno y
oxígeno. Los carbohidratos se descomponen en los intestinos
para dar glucosa
C6H12O6, que es soluble en la
sangre y en el cuerpo humano se conoce como
azúcar de la sangre. La
glucosa es transportada por la sangre a las células, donde
reacciona con O2 en una serie de pasos para producir
finalmente CO2(g), H2O(l) y
energía.
Tipos de carbohidratos.
- Monosacáridos. No pueden hidrolizarse.
- Disacáridos. Al hidrolizarse producen dos
monosacáridos. - Oligosacáridos. Al hidrolizarse producen de
tres a diez moléculas de monosacáridos. - Polisacáridos. Al hidrolizarse producen
más de diez moléculas de monosacáridos.
Función de los carbohidratos
Los carbohidratos desempeñan diversas funciones, siendo las de reserva
energética y formación de estructuras las dos más
importantes; pero, ¿cuál es su verdadera función?
la función de estos "hidratos de carbono" es mantener la
actividad muscular, la temperatura corporal, la tensión
arterial, el correcto funcionamiento del intestino y la actividad
neuronal.
Metabolismo de carbohidratos
Los carbohidratos representan las principales moléculas
almacenadas como reserva en los seres vivos junto con los
lípidos. Los
glúcidos son las principales sustancias elaboradas en la
fotosíntesis y son
almacenados en forma de almidón en cantidades elevadas en
las plantas. El producto equivalente
en los animales es el glucógeno, almacenado también en
cantidades importantes en el músculo y en el hígado. En
el músculo proporciona una reserva que puede ser
inmediatamente utilizada como fuente de energía para la
contracción muscular y en el hígado sirve como
reservorio para mantener la concentración de glucosa en
sangre. Al contrario que los carbohidratos, los lípidos
sirven para almacenar y obtener energía a más largo
plazo. Aunque muchos tejidos y órganos animales
pueden usar indistintamente los carbohidratos y los lípidos
como fuente de energía, otros, principalmente los
eritrocitos y el tejido nervioso (cerebro), no pueden catalizar los
lípidos y deben ser continuamente abastecidos con glucosa.
Los monosacáridos son los productos digestivos finales de
los glúcidos que ingresan a través de la
circulación portal al hígado donde, alrededor del 60%,
son metabolizados. En el hígado, la glucosa también se
puede transformar en lípidos que se transportan
posteriormente al tejido adiposo.
Lípidos
Los lípidos son biomoléculas orgánicas formadas
básicamente por carbono e hidrógeno y generalmente
también oxígeno; pero en porcentajes mucho más
bajos. Además pueden contener también fósforo,
nitrógeno y azufre.
Es un grupo de sustancias muy heterogéneas que sólo
tienen en común estas dos características:
- Son insolubles en agua
- Son solubles en disolventes orgánicos, como éter,
cloroformo, benceno, etc.
Clasificación de los lípidos
Los lípidos se clasifican en dos grupos, atendiendo a que
posean en su composición ácidos grasos (lípidos
saponificables) o no lo posean (lípidos
insaponificables)
I. Líquidos
saponificables
A. Simples
1. Acilglicéridos.
2. Céridos
B. Complejos
1. Fosolípidos
2. Glucolípidos
II. Lípidos insaponificables
A. Terpenos.
B. Esteroides.
C. Prostaglandinas.
Proteínas
Las proteínas son compuestos químicos muy complejos
que se encuentran en todas las células vivas: en la sangre,
en la leche, en los huevos y en toda
clase de semillas y pólenes. Hay ciertos elementos
químicos que todas ellas poseen, pero los diversos tipos de
proteínas los contienen en diferentes cantidades. En todas
se encuentran un alto porcentaje de nitrógeno, así como
de oxígeno, hidrógeno y carbono. En la mayor parte de
ellas existe azufre, y en algunas fósforo y hierro.
Las proteínas son sustancias complejas, formadas por la
unión de ciertas sustancias más simples llamadas
aminoácidos, que los vegetales sintetizan a partir de los
nitratos y las sales amoniacales del suelo. Los animales
herbívoros reciben sus proteínas de las plantas;
el hombre puede obtenerlas de
las plantas o de los animales, pero las proteínas de origen
animal son de mayor valor nutritivo que las vegetales. Esto se
debe a que, de los aminoácidos que se conocen, que son
veinticuatro, hay nueve que son imprescindibles para la vida, y
es en las proteínas animales donde éstas se encuentran
en mayor cantidad.
El valor químico (o "puntuación química") de
una proteína se define como el cociente entre los miligramos
del aminoácido limitante existentes por gramo de la
proteína en cuestión y los miligramos del mismo
aminoácido por gramo de una proteína de referencia. El
aminoácido limitante es aquel en el que el déficit es
mayor comparado con la proteína de referencia, es decir,
aquel que, una vez realizado el cálculo, da un valor
químico mas bajo. La "proteína de referencia" es una
proteína teórica definida por la FAO con la
composición adecuada para satisfacer correctamente las
necesidades proteicas. Se han fijado distintas proteínas de
referencia dependiendo de la edad, ya que las necesidades de
aminoácidos esenciales son distintas. Las proteínas de
los cereales son en general severamente deficientes en lisina,
mientras que las de las leguminosas lo son en aminoácidos
azufrados (metionina y cisteina). Las proteínas animales
tienen en general composiciones más próximas a la
considerada ideal.
El valor químico de una proteína no tiene en cuenta
otros factores, como la digestibilidad de la proteína o el
hecho de que algunos aminoácidos pueden estar en formas
químicas no utilizables. Sin embargo, es el único
fácilmente medible. Los otros parámetros utilizados
para evaluar la calidad de una proteína
(coeficiente de digestibilidad, valor biológico o
utilización neta de proteína) se obtienen a partir de
experimentos dietéticos con animales o con voluntarios
humanos.
Estructura La organización de una
proteína viene definida por cuatro niveles estructurales
denominados: estructura primaria, estructura secundaria,
estructura terciaria y estructura cuaternaria. Cada una de estas
estructuras informa de la disposición de la anterior en el
espacio. El orden, o secuencia de los aminoácidos a lo largo
de una cadena proteínica constituye su estructura
primaria. Esta confiere a la proteína si identidad individual. Un
cambio de incluso un aminoácido puede alterar las
características bioquímicas de la proteína.
Las cadenas de los seres vivos no son simplemente cadenas
flexibles con formas al azar. Por el contrario, las cadenas se
enrollan o se alargan de modos específicos. La
estructura secundaria de una proteína se
refiere a la orientación de los segmentos de la cadena
proteínica de acuerdo con el patrón regular. Existen
dos tipos de estructura secundaria:
·
hélice α (alfa).- Esta estructura se forma al
enrollarse helicoidalmente sobre sí misma la estructura
primaria. Se debe a la formación de enlaces de
hidrógeno entre el -C=O de un aminoácido y el
-NH- del cuarto aminoácido que le sigue
· La
conformación β (beta).- En esta
disposición los aminoácidos. No forman una hélice
sino una cadena en forma de zigzag, denominada disposición
en lámina plegada.
La estructura terciaria informa sobre la
disposición de la estructura secundaria de un
polipéptido al plegarse sobre sí misma originando una
conformación globular.
Preguntas de
química
1.- La Química estudia:
a) Los cambios internos de la materia. | b) Los movimientos de los cuerpos. |
c) Los fluidos y la energía. | d) Los seres vivos y sus relaciones. |
e) Los metales y los no metales.
2.- ¿Qué es la materia?
a) Cualquier sustancia que contenga energía | b) Cualquier sustancia sólida |
c) Todo lo que nos rodea y ocupa un lugar en el | d) Cualquier sustancia fluida y plástica |
e) Cualquier sustancia que transmita energía
3.- Si observamos un diamante, sus propiedades físicas
son, por ejemplo
a) Su porosidad y homogeneidad | b) Su estructura molecular y estado atómico |
c) Su estado de agregación, dureza y tenacidad | d) Sus reacciones típicas y su maleabilidad |
e) Su peso y número atómico
4.- Si observamos un frasco conteniendo cloro gaseoso,
estamos determinando sus propiedades químicas si:
a) Pesamos y olemos el gas confinado. | b) Anotamos el color del gas y |
c) Comprobamos su pureza y lo hacemos reaccionar con | d) Medimos su volumen, su temperatura y la presión que ejerce |
e) Cambiamos su estado de agregación líquido.
5.- El agua puede cambiar de
estado de agregación: de sólido (hielo) a líquido
(agua) de líquido a gas (vapor). ¿De que dependen estos
cambios?
a) Del volumen y la temperatura | b) Del peso y la densidad | c) De la viscosidad y la | d) De la temperatura y la presión | e) De masa y el volumen |
6.-Existen dos tipos de sustancias según su
composición:
a) Sólidas y fluidos | b) Puras y mezclas | c) Elementos y Compuestos | d) Homogéneas y heterogéneas | e) Metales y no metales |
7.-Una mezcla es:
a) La dilución de una sustancia en otra | b) La unión de dos sustancias sin combinarse |
c) La combinación química de dos o más | d) La unión de solventes y solutos |
a) Aceite en agua
8.- El aire es una mezcla homogénea
por que:
a) Los gases que lo componen | b) Unos gases están dispersos en otros |
c) No podemos distinguir un gas componente de otro por | d) Podemos separa a los gases componentes filtrando la |
e) Lo único que lo compone es el oxigeno
Aire = O2 + N2 + He +
H2O + CO + AR + O3 + Kr + …etc.
9.- Una solución es una mezcla homogénea formada por
soluto y solvente, por ejemplo:
a) Cal y arena a partes iguales | b) Agua y aceite en un recipiente |
c) Arena y agua en una playa | d) Sal y agua en vaso de cristal |
e) Papel y pegamento
10.- ¿Qué es un elemento?
a) La menor cantidad de materia sólida | b) Una sustancia que pude dividirse entre otras |
c) Una forma de materia pura que no puede descomponerse | d) La unión de dos o más sustancias |
e) Dos sustancias con el mismo número atómico, pero
distinto peso atómico.
11.- Dejar que un carrito de madera ruede en un plano
inclinado es un fenómeno físico por que:

a) Cambia el estado de | b) El carrito de madera se transforma en otra cosa. |
c) La energía del carrito modifica el plano | d) El carrito de madera sólo cambia su |
e) El plano inclinado modifica la energía del
carrito.
12.- Quemar el carrito de madera anterior es un fenómeno
químico por que;
a) La madera se transforma en dióxido de carbono y | b) La madera pasa del estado sólido al estado |
c) La energía del carrito se combina | d) La madera no cambia, sólo libera su |
e) La energía utilizada es igual a la cantidad de materia
del carrito
13.- Cuando un trozo de oro es calentado y se
transforma en oro líquido ocurre una:
a) Licuefacción | b) Fusión | c) Evaporación | d) Condensación | e) Sublimación |
14.- Bajo ciertas condiciones de temperatura y
presión, el vapor de agua se solidifica bruscamente formando
escarcha, este cambio de estado se llama:
a) Licuefacción | b) Condensación | c) Deposición | d) Sublimación | e) Solidificación |
15.- La energía es:
a) La fuerza motriz de un cuerpo | b) La capacidad de moverse propia de la materia |
c) La capacidad de la materia para efectuar | d) El trabajo realizado por |
e) El tiempo en que un cuerpo realiza un trabajo
16.- La combustión es una
reacción de oxidación violenta que libera energía
en forma de calor y luz, por esto, la combustión
es:
a) Una reacción adiabática | b) Una reacción de doble desplazamiento |
c) Una reacción de síntesis | d) Una reacción exotérmica |
e) Una reacción nuclear
17.- Poco antes de la Revolución Francesa, Antoine
L. Lavoisier anunció la Ley de la Conservación de la
masa, que dice:
a) La masa cambia en una reacción pero la | b) Las sustancias se transforman en otras más | |
c) En todo cambio químico se pierde algo de masa en | d) La materia no se crea ni se destruye, sólo se | |
e) El peso es la medida cualitativa de la masa.
18.- El inglés John Dalton
enunció la Teoría Atómica que
dice:
a) La energía no se crea ni se destruye, sólo | b) Cada elemento tiene su propio átomo con |
c) Las moléculas de los gases no interactúan | d) A temperatura constante, la presión de un gas es |
e) El átomo es la menor cantidad de materia.
19.- A sus partes se les llaman componentes:
a) Compuesto | b) Solución | c) Mezcla | d) Coloide | e) Soluto |
20.- Filósofo griego que propuso que el átomo era la
mínima cantidad de materia y que ya no se podía dividir
más:
a) Aristóteles | b) Arquímedes | c) Demócrito | d) Pitágoras | e) Tales |
21-Propuso un modelo atómico que
representaba al átomo como una esfera con carga positiva y
dentro de ella están los de carga negativa como pasas
de un pastel.
a) Einstein | b) Thomsom | c) Bohr | d) Rhuterford | e) Lewis |
22.- Propuso un modelo atómico formado por un núcleo
de carga positiva alrededor del cual giran
los electrones con carga negativa en
niveles de energía u órbitas circulares, a semejanzas
del sistema planetario:
a) Planck | b) Einstein | c) Bohr | d) Rydberg | e) Thomsom |
23.- Configuración electrónica del
Nitrógeno (número atómico = 7):
a) 1s2 | b) 1s2 | c) 1s2 3p4 | d) 1s2 3s2 | e) 1s2 2s 2p4 |
24.- El K+ es un átomo de potasio al que
se ha "arrebatado" un electrón, quedando cargado
positivamente, por lo tanto, se trata de un:
a) Catión | b) Isótopo | c) Anión | d) Protón | e) Neutrón |
| Página siguiente |




