Proceso de transformación de la energía química en eléctrica en los acumuladores de energía de la batería de automóviles (página 2)
El fundamento de las pilas y
acumuladores es la transformación de la energía
química en
eléctrica, mediante reacciones de
oxidación-reducción producidas en los electrodos,
que generan una corriente de electrones. Cuando se unen mediante
un hilo metálico dos cuerpos entre los cuales existe una
diferencia de potencial, se produce un paso de corriente que
provoca la disminución gradual de dicha diferencia. Al
final, cuando el potencial se iguala, el paso de corriente
eléctrica cesa. Para que la corriente siga circulando
debe mantenerse constante la diferencia de potencial.
En el desarrollo de
las actividades relacionadas con el uso de la energía
eléctrica, el hombre se
ha visto en la necesidad de crear fuentes de
energía que permitan realizar diferentes trabajos, por
ejemplo, debido a las deficiencias de electricidad, ha
habido la necesidad de utilizar fuentes de energía
alternativas, es por ello que en el uso de los computadores para
los ingenieros en informática, es de vital importancia y
éstos equipos deben poseer fuentes de energía que
los hagan trabajar, pero al fallas la energía
eléctrica, es necesario buscar fuentes de energía
alternativas, es allí donde se utilizan las
baterías de gran carga donde se transforma la
energía química en eléctrica, lo cual es de
mucha utilidad en el
área planteada, para evitar pérdidas de información importante.
Es por ello que se pretende estudiar como se realiza el
proceso de
transformación de la energía química en
eléctrica en los acumuladores de energía de la
batería de automóviles, vinculando su utilidad al
desarrollo de sistemas de
computación integrados de forma eficiente y
confiable.
1.2 Objetivo
General
Describir el proceso de transformación de la
energía química en eléctrica en los
acumuladores de energía de la batería de
automóviles.
1.3 Objetivos
Específicos
Definir los elementos que intervienen en el proceso de
transformación de energía química y
eléctrica.Explicar los componentes que posee una batería de
automóvil vinculados al proceso de
transformación de energía química en
energía eléctrica.Detallar el proceso de transformación de
energía química a energía
eléctrica en una batería de
automóvil.
1.4 Justificación e Importancia
Este proyecto se
justicia en el
sentido que brinda un aporte relacionado con la ingeniería
de sistemas, en cuanto al desarrollo y conocimiento
de las diversas alternativas de energía para la
utilización y funcionamiento de procesadores de
forma eficiente (cuando la luz
eléctrica no sea la adecuada o simplemente falle) a
través del estudio de los componentes de las
baterías de automóviles, con miras a la
utilización de éstas para el desarrollo de sistemas
operativos que permitan salvaguardar información de
importancia de diversas empresas,
instituciones,
etc., ya que uno de los objetivos más interesantes de la
Cátedra Física II, se
relacionan con la energía potencial, la cual amplia su
campo de acción
en el desarrollo de las actividades científicas.
La energía potencial es la capacidad que tienen los
cuerpos para realizar un trabajo,
dependiendo de la configuración que tengan en un sistema de
cuerpos que ejercen fuerzas entre sí. Puede pensarse como
la energía almacenada en un sistema, o como una medida del
trabajo que un sistema puede entregar. Más rigurosamente,
la energía potencial es una magnitud escalar asociada a un
campo de fuerzas (o como en elasticidad un
campo tensorial de tensiones).
De ella se desprenden otros tipos de energía, como la
química y la eléctrica las cuales se vinculan al
trabajo que se pretende realizar, relacionado con el proceso de
transformación de la energía química en
eléctrica en los acumuladores de energía de la
batería de automóviles.
La Ingeniería de sistemas es un modo de
enfoque interdisciplinario que permite estudiar y comprender la
realidad, con el propósito de implementar u optimizar
sistemas complejos. Puede verse como la aplicación
tecnología
de la teoría de
sistemas a los esfuerzos de la ingeniería, adoptando
en todo este trabajo el paradigma
sistémico. La ingeniería de sistemas integra otras
disciplinas y grupos de
especialidad en un esfuerzo de equipo, formando un proceso de
desarrollo estructurado.
CAPÍTULO II
Marco
teórico
2.1 Antecedentes de la
Investigación
Los sistemas de acumulación de energía, si bien
constituyen una imagen moderna y
propia de nuestros tiempos, constituyeron elementos
estratégicos a lo largo de la historia de la humanidad. A
modo de ejemplo veamos algunos hechos importantes en el
desarrollo de las baterías:
1796 Alessandro Giuseppe Antonio Anastasio Volta, un
profesor de la
Universidad de
Pavia, Italia; construye
la primer celda, la "pila voltaica". Lleva ese nombre por haber
"apilado" discos de plata y cinc separados entre si por un
separador embebido en electrolito.
1813 Sir Humphry Davy, utiliza una batería
gigantesca.(20.000 pares!), donada por Napoleon, en
el sótano de la Sociedad Real
Británica y la utiliza para experimentos de
electrólisis.
1859 Raymond Gastón Planté, inventa el
acumulador de plomo (batería plomo- ácido), pero no
fue de gran utilidad..no se había inventado "la
electricidad"..no había nada que acumular!.
1866 George Leclanché, inventa en Francia la
"pila seca" (Zinc-Dióxido de Manganeso); sistema que
aún domina el mercado mundial
de las baterías primarias.
1871 Se inventa la dínamo, comienza la producción industrial de
baterías.
1887 El gobierno
francés utiliza baterías para movilizar un bote
submarino, (primeros vehículos eléctricos)
1893 Funciona un trolebús en la 5ta. Avenida,
New York.
1900 Tomas Alva Edison, el gran inventor, patenta la
batería níquel-hierro, entre
otros usos, la emplea para propulsar su vehículo
eléctrico!. Jugner, un inventor sueco, patenta la
batería de níquel-cadmio.
1947 Se desarrolla de celda de mercurio,
donde en la descarga se emplea un cátodo de HgO, que si
bien le proporciona buenas características a la
batería, tiene alto costo y
finalmente por consideraciones ambientales fue dejada de
lado.
1960 Investigadores alemanes desarrollan las
batería plomo-ácido con el electrolito inmovilizado
(en forma de gel).
1967 La Gates Corporation desarrolla la batería
de plomo-ácido "libre mantenimiento"
o "sellada". El diseño
permite que los gases
liberados en la sobrecarga se recombinen en el interior de la
batería. Cuenta también con una válvula de
seguridad para
los casos de una excesiva sobrecarga.
1970 A finales de esta década Sony introduce la
primer batería empleando ánodos de Li. En 1990 esta
empresa
comercializa mundialmente la primer batería de
Litio/ión. Dada la alta densidad de
energía que presenta este sistema, produce el doble de
voltaje que una batería alcalina.
2.2 Bases Teóricas
La Energía Química
La energía química es una manifestación
más de la energía. En concreto, es
uno de los aspectos de la energía interna de un cuerpo y,
aunque se encuentra siempre en la materia,
sólo se nos muestra cuando se
produce una alteración íntima de ésta.
En la actualidad, la energía química es la que
mueve los automóviles, los buques y los aviones y, en
general, millones de máquinas.
Tanto la combustión del carbón, de la
leña o del petróleo en las máquinas de vapor
como la de los derivados del
petróleo en el estrecho y reducido espacio de los
cilindros de un motor de
explosión, constituyen reacciones
químicas.

El carbón y la gasolina gasificada se combinan con el
oxígeno
del aire,
reaccionan con él y se transforman suave y lentamente, en
el caso del carbón, o instantánea y
rápidamente, en el caso de la gasolina dentro de los
cilindros de los motores. Las
mezclas
gaseosas inflamadas se dilatan considerable y rápidamente
y en un instante comunican a los pistones del motor su
energía de traslación, su fuerza viva o
de movimiento.
Si se rodea en el carbón o la leña, la gasolina
y el
petróleo de una atmósfera de gas inerte, por
ejemplo nitrógeno gaseoso, ni los primeros arderían
ni los últimos explotarían en los cilindros. El
nitrógeno no reacciona con aquellos cuerpos y las mezclas
de gasolina y nitrógeno ni arden ni explotan.
Finalmente, hay que mencionar la más reciente y
espectacular aplicación de la energía
química para lograr lo que durante muchos siglos
constituyó su sueño: el viaje de ida y vuelta al
espacio exterior y a la Luna, así como la
colocación de distintos tipos de satélites
artificiales en determinadas órbitas.
La energía es una propiedad
inherente a la materia. La materia posee energía
almacenada que se debe, por una parte, a la posición o a
la altura de un cuerpo (energía cinética) y, por
otra, a la naturaleza o
las sustancias de que esté hecho el cuerpo al que se hace
referencia, ya que a cada elemento o compuesto le corresponde
cierta cantidad de energía química almacenada a la
que se le denomina contenido energético. Cuando se lleva a
cabo un fenómeno químico, éste va
acompañado por una manifestación de energía,
ya sea que haya absorción o desprendimiento de ella,
debido a la energía química que almacenan las
sustancias
Lo anterior significa que, cuando la energía
química almacenada de los reactivos es mayor que la
energía de los productos, hay
un excedente de energía que se libera, pues la
energía se mantiene constante, es decir, no se crea ni se
destruye.
Por ejemplo, al reaccionar metano (gas
combustible) con el oxígeno (gas comburente), hay
desprendimiento de energía como producto,
porque el contenido energético del metano y del
oxígeno es mayor al que posee el dióxido de
carbono y
el agua, que
son las sustancias que se forman durante la reacción:

Por lo tanto, si, al reaccionar, una o varias sustancias
producen otras con mayor contenido energético,
habrá absorción de energía por parte de los
reactivos, como lo muestra la siguiente reacción de
fotosíntesis:

Las sustancias de gran contenido energético se utilizan
como combustible, ya que al reaccionar con el oxígeno se
genera una gran cantidad de energía en forma de luz y
calor.
Energía química en un motor
Las reacciones químicas de combustión de
compuestos de carbono con oxígeno para liberar
energía son bien conocidas por todos. Ocurren, por
ejemplo, al quemar madera o gas
en el horno o bien cuando la bencina de un auto proporciona la
energía necesaria para su funcionamiento. Estas reacciones
son demasiado violentas y poco controladas para que los
organismos vivientes las puedan usar dentro de una célula.
Para que un motor funcione, éste requiere de
combustible que, al reaccionar, desprende energía. En el
caso del motor de combustión interna, la energía
del combustible se transforma en potencia y
movimiento, de tal forma que la fuerza producida sirve para hacer
funcionar un autobús, una hélice y un generador,
entre otras cosas.
El motor de cuatro tiempos es el motor de
combustión interna más conocido, y su
funcionamiento se lleva a cabo en cuatro etapas, las cuales
son:Primer tiempo (admisión): tiene lugar la
penetración de una mezcla de combustible y aire a la
válvula de admisión, al bajar el
pistón.Segundo tiempo (compresión): el
pistón sube y comprime la mezcla al reducir el
volumen.Tercer tiempo (explosión): al encender la
bujía, ésta provoca la explosión de la
mezcla; en este momento el pistón es empujado y
baja.Cuarto tiempo (expulsión): los gases
producidos por la explosión son expulsados a
través de la válvula de expulsión; en
este momento el pistón baja.

Representación esquemática del funcionamiento de
un motor de cuatro tiempos.
La combustión
La combustión es una oxidación violenta, la
cual, a su vez, desprende energía en forma de calor y luz.
Los principales productos de ella son: el CO2, el vapor de
agua y la
energía. Ejemplos de este proceso son la combustión
del gas de la estufa, de la leña, y del carbón. En
todos estos fenómenos se presenta una
oxidación y, por lo tanto, también tiene
lugar una reducción, ya que cuando se produce la
combustión de una de estas sustancias, el oxígeno
se reduce ganando electrones y el elemento que se oxida los
pierde.
En el organismo de los seres vivos existen procesos de
"combustión orgánica", los cuales se denominan
así por la similitud que guardan con los productos
obtenidos. Sin embargo, no son propiamente combustiones, pues no
son, oxidaciones violentas.
Un ejemplo de éstas es la degradación de la
glucosa que,
durante la respiración celular, produce CO2, H2O y
energía, de acuerdo con la siguiente reacción:

En esta ecuación se observa que cada átomo de
oxígeno "gana" 2 electrones (se reduce) y el carbono
"pierde" 4 electrones (se oxida).

La oxidación del gas butano es una combustión
inorgánica, ya que no se efectúa en los seres
vivos. Su reacción es la siguiente:

Energía Eléctrica
Se denomina energía eléctrica a la forma de
energía que resulta de la existencia de una diferencia de
potencial entre dos puntos, lo que permite establecer una
corriente eléctrica entre ambos —cuando se les
coloca en contacto por medio de un conductor
eléctrico—para obtener trabajo. La energía
eléctrica puede transformarse en muchas otras formas de
energía, tales como la energía luminosa o luz, la
energía mecánica y la energía
térmica.
Su uso es una de las bases de la tecnología utilizada
por el ser humano en la actualidad. La energía
eléctrica se manifiesta como corriente eléctrica,
es decir, como el movimiento de cargas eléctricas
negativas, o electrones, a través de un cable conductor
metálico como consecuencia de la diferencia de potencial
que un generador esté aplicando en sus extremos.
Cada vez que se acciona un interruptor, se cierra un circuito
eléctrico y se genera el movimiento de electrones a
través del cable conductor. Las cargas que se desplazan
forman parte de los átomos de— que se desea
utilizar, mediante las correspondientes transformaciones; por
ejemplo, cuando la energía eléctrica llega a una
enceradora, se convierte en energía mecánica, calórica y en algunos
casos luminosa, gracias al motor eléctrico y a las
distintas piezas mecánicas del aparato.
Acumuladores eléctricos
Hablar de la relación entre la electroquímica y la energía nos
conduce a una relación mas que obvia, puesto que en
definitiva un proceso electroquímico cualquiera lleva
implícito un cambio de
energía. Desde el punto de vista del aprovechamiento por
el hombre de la
energía nos permite centrar el estudio en la
energía eléctrica. Este tipo de energía como
sabemos puede ser producida de diversas maneras, por
combustión de un combustible adecuado (centrales
térmicas), aprovechando la caída de un curso de
agua (centrales hidroeléctricas), aprovechando la
energía liberada por una reacción de
descomposición radioactiva (centrales atómicas),
etc., como las principales tecnologías empleadas
actualmente, a las que se suman otras como las
geotérmicas, eólicas, fotovoltaicas, etc.
Un punto clave para el aprovechamiento de la energía
generada es la mayor o menor facilidad para utilizar esa
energía, es decir que en algunos casos una forma de
producción es económica siempre y cuando la
energía sea utilizada en el momento, el problema surge
cuando se plantea la posibilidad de almacenar esa energía
eléctrica. Es aquí donde toman especial relevancia
los acumuladores de energía.
Como definición de estos sistemas podemos emplear
aquella que dice que "son sistemas que permiten la
acumulación de energía" (estamos utilizando el
título como definición!), pero tal vez nos quede
mas claro si decimos que son sistemas donde ocurre
conversión de energía química (almacenada)
en energía eléctrica y viceversa.
Los dos procesos importantes relacionados con el
funcionamiento de las baterías son respectivamente la
carga y descarga de las mismas. Durante la carga el sistema se
aleja del equilibrio
termodinámico mediante la aplicación de
energía externa. En el caso de las baterías no
recargables esto se produce en el momento de su manufactura.
En la etapa de descarga el sistema trata de alcanzar el
equilibrio, se producen reacciones espontáneas y los
electrones intercambiados son aprovechados mediante un
circuito externo.
DESCRIPCIÓN DE UNA CELDA
Independientemente del tipo de acumulador que consideremos y
de la geometría
final que este posea, todos estos sistemas están
compuestos por los mismos componentes básicos:
Ánodo: Es aquel electrodo donde ocurre
la reacción de oxidación, pérdida de
electrones. Por convención su signo varía en una
batería secundaria cuando es cargada o descargada.
Cátodo: Electrodo donde ocurre la
reacción de reducción, ganancia de electrones. En
el diseño de ambos electrodos se procura utilizar materiales
livianos, de gran área, de buena conductividad,
resistentes a la corrosión, etc.
Material activo: Se refiere a la masa que
realmente participa en el proceso electroquímico. Este
parámetro es muy importante puesto que está ligado
directamente a la eficiencia
electroquímica. Muchos sistemas tienen una baja eficiencia
puesto que gran parte del material que se incorpora en los
electrodos tiene solo una función
estructural.
Separador: Este material permite ubicar los
electrodos lo mas próximo posible, importante por el
espacio que ellos ocupan, pero impide que los mismos estén
en un contacto directo, puesto que esta situación
provocaría que reaccionaran directamente sin posibilidad
de aprovechar esa energía. Se construyen de un material
inerte poroso que permita el flujo de electrolito.
Electrolito: Componente importante puesto que
esta solución permite la conducción iónica
en el interior de la batería y contiene reactivos y
productos de los procesos electroquímicos. En algunos
casos el electrolito se encuentra embebido formando una pasta,
como en el caso de la pila "seca", inmovilizado como en las
baterías "tipo gel", o en forma líquida como en el
caso de las baterías alcalinas (solución de KOH) o
en las de plomo-ácido (solución de H2SO4)
Contenedor: Se construyen de materiales
resistentes al ataque químico de los componentes y aportan
resistencia
mecánica al acumulador. En tiempos recientes se
están fabricando a partir de materiales plásticos,
lo que permite una mejor visión del nivel de electrolito,
disminución de peso y posibilidad de reciclaje.
Clasificación de los Acumuladores o
Baterías
Una batería forman parte del entorno diario (y mucho
mas de lo que imaginamos), sin embargo cuando se analiza las
aplicaciones, la forma de trabajar, de cómo se construyen,
etc. Se observa que pueden ser bastante diferentes entre si, por
lo que intentará una clasificación que no
será por cierto estricta, sino siguiendo la
tradición electroquímica.
Baterías Primarias
Aquellas que tienen energía almacenada en forma de
reactivos químicos que se libera como energía
eléctrica cuando son conectadas, pero lo hacen en un solo
ciclo, es decir que una vez descargadas no es posible
recuperarlas. Se dice que tienen un solo ciclo de descarga. El
ejemplo mas conocido entre nosotros es la "pila seca" o de
Leclanché, ampliamente utilizada por ejemplos en
electrodomésticos.
Esta pila utiliza como ánodo Zn y el cátodo es
una pasta de MnO2 junto con C que actúa como colector de
la corriente. El electrolito es una pasta ácida de NH4Cl y
ZnCl2.
Las correspondientes reacciones son:
Zn + H2O _ ZnO + 2e + 2H+ (ánodo)
2MnO2 + 2e + 2H+ _2MnOOH (cátodo)
Zn + 2MnO2 + H2O _ZnO + 2MnOOH (reacción
neta)
A pesar de la creencia popular, esta reacción es
irreversible termodinámicamente por lo que no es factible
recargar la pila independientemente del tratamiento físico
a que se la someta. Dentro de esta misma familia, en los
últimos años se comenzó a comercializar las
denominadas "baterías alcalinas", en las que se
reemplazó el electrolito ácido por KOH (al 30%), y
la reacción anódica es ahora Zn + 4 OH- _ Zn(OH)4
2- + 2e
Baterías secundarias
Aquellas que las reacciones químicas que participan en
la conversión de energía pueden ser revertidas en
un grado mas o menos completo, en otras palabras sistemas que
permiten ser recargados, es decir que poseen mas de un ciclo de
carga y descarga (pueden ser miles). En este tipo de
baterías se encuentra el sistema mas popular del mundo, la
batería de plomo, conocida como plomo-ácido en
relación al electrolito que utiliza, la que a pesar de
tener mas de un siglo de inventada brinda prestaciones
que no han sido superadas totalmente hasta ahora. Utiliza como
electrolito una solución de ácido sulfúrico
con densidad 1,28 g/ml a 25oC.
En este caso las reacciones de electrodo pueden simplificarse
como:
Pb + H2SO4 _ PbSO4 + 2e + 2H+ (en el ánodo) PbO2 +
2H2SO4 _PbSO4 + 2H2O + SO4 2- (en el cátodo) Pb + PbO2 +
2H2SO4 _ 2PbSO4 + 2H2O (reacción global).
Un detalle particular es el rol del ácido
sulfúrico, ya que si bien no sufre directamente
reacción de oxidación o reducción, dado que
se consume durante el funcionamiento de la batería conduce
a una disminución de la densidad del solución de
electrolito, por lo que se emplea esta magnitud para estimar
el estado de
carga de la batería.
Otra batería de gran uso industrial, y en los
últimos años con la aparición de la telefonía
celular, son las alcalinas del tipo de Níquel-Cadmio o
Níquel-Hierro. En este caso el ánodo es de Cd o Fe
según el caso y el cátodo es un electrodo
impregnado de hidróxido de níquel el que cuando
actúa como cátodo de la batería se encuentra
como NiOOH. El electrolito es una solución concentrada
(30%) de KOH. Las reacciones correspondientes son M + 2OH-
_M(HO)2 + 2e (en el ánodo, con M= Cd o Fe) 2NiOOH + 2H2O +
2e _Ni(OH)2 +2OH- (en el cátodo) M + 2NiOOH + 2H2O + _
M(OH)2 + 2Ni(OH)2 (reacción neta)
Celdas de combustible
Si bien no son estrictamente iguales a los sistemas anteriores
se las suele incluir en esta clasificación. En las celdas
de combustión la energía eléctrica es
obtenida también a partir de una reacción
química, pero en estos sistemas los reactivos no se
encuentran en el interior de la celda sino que son alimentados
continuamente de depósitos externos.
Esta característica le permite trabajar continuamente
mientras haya disponibilidad de re activos. Existen
distintos tipos de celdas de combustión, diferenciadas
fundamentalmente por la temperatura de
trabajo, la mas conocida es la celda de ácido
fosfórico. Este tipo de sistemas de
producción de energía implica el uso de una
tecnología especial y costosa, que provocó que en
sus inicios tuviera una limitada aplicación,
fundamentalmente en el campo aeroespacial; pero en los
últimos tiempos se están desarrollando sistemas de
menor costo y aplicaciones mas cotidianas, fuentes de poder,
vehículos eléctricos, etc. Las reacciones
espontáneas que ocurren en la celda son la
oxidación del hidrógeno en el ánodo y la
reducción del oxígeno en el cátodo para dar
lugar a la formación de agua. 2H2 + O2 _ 2H2O
Los principales inconvenientes provienen de la necesidad de
emplear reactivos de alta pureza y que las reacciones ocurren
sobre la superficie de metales
catalizadores como el platino, de alto costo y con posibilidad de
sufrir "envenenamiento" por impurezas
Parámetros de importancia
Desde el punto de vista del comportamiento
electroquímico de estos sistemas se estudian algunos
parámetros de importancia, para poder analizar en
qué estado se
encuentran las baterías.
Voltaje
El valor
dependerá del sistema de ánodo y cátodo que
se tenga así como de los respectivos sobre-potenciales que
tengan esos electrodos V= Ec – Ea –hA – hC
Para obtener el mayor voltaje en una batería, es
útil combinar dos electrodos que tengan potenciales muy
diferentes (Ec y Ea), además de diseñar y operar la
batería de manera de disminuir al máximo la
polarización (hA-hC).
Corriente
Directamente relacionado con la aplicación, se
podrá requerir que sea constante pero en un largo
período de tiempo; por
ejemplo en un marcapasos se necesitarán corrientes del
orden de los micro amperes (1×10-7 ampere) durante un largo
período de tiempo (años). Mientras que en el
lanzador de un torpedo, se requieren que en un segundo pasen 5000
amperes!
Capacidad
Da una idea de la carga almacenada y disponible en la
batería. Este valor está limitado por el electrodo
de menor capacidad. Se la expresa en unidades de carga como
Ampere x hora (Ah). Por ejemplo para una batería de
tracción la capacidad es del orden de 10 a 20 kAh,
mientras que para una batería que mantiene la memoria de
un computador es
del orden de 0,1 a 0,5 Ah
Densidad de almacenamiento de
energía
Es una medida de la carga por unidad de peso total de la
batería. Esto resulta especialmente importante para
baterías de tracción en vehículos
eléctricos o uso aeroespacial.
Densidad de Potencia
Es la potencia por unidad de peso de la batería.
Velocidad de descarga
Se la expresa como un cociente: C/n y es la corriente que
permite descargar la capacidad C en n horas.
Vida media
Cantidad de ciclos de carga y descarga a los que se puede
someter la batería antes de
terminar su vida útil.
Eficiencia de energía
Es el cociente entre la energía obtenida en la descarga
y la energía empleada para cargar la batería.
Comportamiento ante la sobrecarga
De importancia para las baterías secundarias, ya que
reacciones secundarias (por ejemplo electrólisis del agua)
pueden disminuir notablemente la vida útil del
sistema.
Autodescarga
Perdida de carga por reacciones químicas que ocurren
aunque el sistema no esté siendo utilizado.
Tolerancia a las condiciones de uso
De acuerdo al uso, se requerirá resistencia a
temperaturas extremas, golpes mecánicos, posición,
etc.
Aplicaciones de los acumuladores
Pensar en un mundo sin baterías, resultaría en
un ambiente bien
diferente de lo que conocemos hoy, esto se debe al gran
número de aplicaciones modernas que tienen estos sistemas
de almacenamiento y conversión de energía. Esta
situación hace que el intento de clasificarlas de acuerdo
al uso de las mismas sea una tarea complicada. Basta realizar un
pequeño ejercicio mental y tratar de enumerar sistemas
donde se utilicen baterías y seguramente nuestro listado
contemplará, juguetes,
radios, motos, satélites, aviones, robots,
marcapasos, computadores, equipos médicos
portátiles, celulares, submarinos, boyas, antenas,
bicicletas eléctricas, linternas, etc.
El diseño y proceso de fabricación de
acumuladores de energía, está ligado a la
aplicación que tendrá, tradicionalmente se destacan
tres tipos de usos diferentes:
Baterías estacionarias: Generalmente son de gran
tamaño, están inmovilizadas en un sitio y se
emplean para acumular grandes cantidades de energía. Estos
acumuladores, por ejemplo pueden ser utilizados en los sistemas
integrados de energía que mencionaremos mas adelante, se
utilizan como fuentes de emergencia, para alimentar equipos
remotos, etc.
Baterías de tracción: Son empleadas para
propulsar motores
eléctricos, se requieren que tengan bajo peso pero una
gran potencia, se emplean en vehículos industriales,
submarinos, etc.
Baterías SLI (Starting, Lighting and
Ignition): Son las empleadas habitualmente en los
vehículos de motor de combustión, pueden ser
recargadas y se utilizan para arrancar el motor, iluminación, etc. Estas clasificaciones en
modo alguno pretenden ser completas, en razón del amplio
espectro de uso de los acumuladores.
Solventes y electrolitos: En cualquier sistema
electroquímico independientemente de la aplicación
y tamaño del mismo, será necesario el empleo de
electrolitos adecuados. Si bien la mayoría de los
experimentos analíticos llevados a cabo en el laboratorio
emplean soluciones
acuosas, puede ser necesario el empleo de solventes
orgánicos o incluso solventes mixtos. De todas maneras se
pueden mencionar algunos aspectos generales que
caracterizarán a los electrolitos empleados en trabajos
electroquímicos.
Características importantes
– Carácter prótico: importante aspecto si
existen intermediarios que puedan reaccionar con el solvente. Es
posible clasificarlos de acuerdo a su capacidad donadora de
protones. Es importante no solo analizar el aspecto
termodinámico de estos equilibrios sino también la
cinética de estos procesos de liberación de
protones. En estudios mecanísticos se prefieren solventes
aproticos, por ejemplo aquellos donadores pobres por estar unidos
los hidrógenos a elementos no muy electronegativos. Esta
preferencia obedece al hecho que los intermediarios,
especialmente los radicales aniones son más estables en
este tipo de solventes.
– Límite de voltaje: para cada solvente existe
un potencial límite anódico y catódico,
más allá donde es imposible estudiar reacciones
electroquímicas de algún determinado soluto, debido
a la oxidación o reducción (descomposición)
del mismo solvente. Estos límites
definen lo que se denomina "ventana de potencial", esto es, la
zona útil de trabajo que permite ese solvente.
– Polaridad del solvente: este parámetro
está en relación con el momento dipolar que
presente el solvente así como de su constante
dieléctrica. Este aspecto es importante especialmente en
relación al proceso de ionización de un determinado
electrolito. Se debe recordar que cuando se tienen dos cargas
eléctricas de signo contrario (el caso de un electrolito
fuerte completamente disociado) la fuerza actuante entre ellas es
inversamente proporcional a la constante dieléctrica del
medio que las separa. Por lo tanto un solvente que tenga una
constante dieléctrica alta, promoverá la
disociación de un soluto iónico y conducirá
a una disminución de la resistencia de la solución.
Por el contrario una baja constante dieléctrica (se
considera por debajo de 15) favorecerá la
asociación iónica formándose los denominados
pares iónicos.
– Rango líquido y presión de
vapor: dado que la mayoría de los experimentos
electroquímicos requieren que se realicen en fase
líquida es importante considerar las temperaturas y
presiones máximas de trabajos que permitan tener el
solvente en ese estado. Asimismo la presión de vapor de
los solventes es importante con relación al proceso de
"purga" que algunas técnicas
requieren. Esto es así puesto que si se trabaja con un
solvente con presión de vapor elevada, podría
suceder que con el pasaje de una corriente de gas inerte se
"arrastrara" la fase vapor del solvente con la correspondiente
complicación para mantener una determinada
concentración del electrolito.
– Viscosidad: este parámetro resulta importante
de analizar especialmente cuando los experimentos
electroquímicos requieren de un adecuado control
difusional, estudios de convección, etc.
– Miscibilidad con otros solventes: el recurso de
emplear solventes mixtos se emplea frecuentemente para analizar
la influencia de un cambio en la constante dieléctrica del
medio. Para este propósito se debe tener en cuenta en que
medida estos solventes son miscibles entre si. Existen tabulados
algunos parámetros que permiten, de manera
empírica,
predecir si una determinada mezcla conducirá a una
solución homogénea.
– Propiedades espectroscópicas: algunas
técnicas electroquímicas implican la
aplicación simultanea de técnicas
espectroscópicas, por ejemplo espectroscopia UV, IR,
visible, etc. En estos casos será importante por lo tanto
considerar las longitudes de onda donde el solvente presenta
interacción con la radiación
ya que de este modo se definirá una "ventana útil"
de trabajo.
Rol Del Sistema Solvente-Electrolito
Para los estudios electroquímicos es importante
considerar esta interacción habida cuenta que se
está modificando la estructura de
la doble capa eléctrica. De este modo por ejemplo se tiene
en cuenta que cuando se tienen solventes orgánicos estos
pueden tener una orientación diferente en
comparación a la que presenta en el seno de la
solución, que los fenómenos de adsorción son
menos pronunciados cuando se emplean solventes orgánicos y
que los iones del electrolito también pueden ser
adsorbidos específicamente en la zona de la doble capa
eléctrica.
Rol Del Electrolito Soporte
En la mayoría de los experimentos
electroquímicos suele emplearse electrolitos que si bien
no constituyen los compuestos de interés en
el proceso, su presencia hace posible controlar el modo en que
ocurren las reacciones en el sistema. Esta importante
función se puede resumir como:
– Regulan la resistencia y el transporte de
masa por migración
eléctrica (minimizan la caída IR)
– Pueden actuar como sistemas buffer
– Pueden actuar como sistemas acomplejantes
– Pueden formar pares iónicos, agregados
micelares, etc. Esto está relacionado con los procesos de
solvatación.
– Determinan la estructura de la doble capa
eléctrica
– Imponen los límites de voltaje debido a su propia
reacción.
2.3 Bases Legales
La Constitución de la
República Bolivariana de Venezuela
(1999), señala lo siguiente, en su artículo 203,
"Son leyes
orgánicas las que así denomina esta
Constitución; las que se dicten para organizar los poderes
públicos o para desarrollar los derechos constitucionales y
las que sirvan de marco normativo a otras leyes".(p.45)
De esto se infiere que la Constitución Venezolana,
respalda las Leyes Orgánicas que han sido procesadas y
aprobadas a través de la Asamblea Nacional, como lo es el
caso de la Ley
Orgánica de Hidrocarburos.
La Seguridad de la Nación
es competencia y
responsabilidad del Estado y se fundamenta en su
desarrollo integral. En Venezuela, en la actualidad, el
desarrollo nacional como pilar fundamental de la seguridad, tiene
como base principal de sustentación los recursos de
hidrocarburos. El aprovechamiento integral de esos recursos
requiere de una ley que le garantice a la Nación
venezolana la optimización de su industria
petrolera, dentro de los parámetros de explotación
racional, garantía de justos ingresos
fiscales, conservación del recurso, contribución al
desarrollo
social y protección del ambiente, acciones
todas, que coadyuvan a fortalecer y a garantizar nuestra
seguridad. Por lo anterior, se puede considerar que la
legislación sobre los hidrocarburos es una de las
más importantes del país, después de la
Constitución, porque debe regular, en forma clara y
precisa, una de las bases de la economía y de la sociedad venezolana.
Según la Ley Orgánica de Hidrocarburos,
señala en su artículo Nº 5 lo siguiente:
Artículo 5°. Las actividades reguladas por este
Decreto Ley estarán dirigidas a fomentar el desarrollo
integral, orgánico y sostenido del país, atendiendo
al uso racional del recurso y a la preservación del
ambiente. A tal fin se promoverá el fortalecimiento del
sector productivo nacional y la transformación en el
país de materias primas provenientes de los hidrocarburos,
así como la incorporación de tecnologías
avanzadas.
Este artículo menciona que cualquier actividad
vinculada con el fomento del desarrollo integral, donde se
transformen materias primas provenientes de hidrocarburos, son
legalmente aceptadas en Venezuela, por tanto se pueden realizar
de forma libre siempre fundamentado en la legislación
venezolana vigente, en el caso de los acumuladores de
energía (baterías), sujeto a la Ley Orgánica
de Hidrocarburos..
2.4 Definición de Términos
Básicos
Acumulador eléctrico: Dispositivo constituido
por un electrolito, un elemento y un contenedor que permite
almacenar la energía eléctrica en forma de
energía química y liberarla cuando se conecta con
un circuito de consumo
externo. (Glosario de
términos sobre baterías)
Acumulador de plomo o una batería de plomo: Es
un acumulador eléctrico en que el material activo de las
placas positivas está formado por compuestos de plomo y el
de las placas negativas es esencialmente plomo y el electrolito,
una solución diluida de ácido sulfúrico.
(Glosario de términos sobre baterías)
Actividad: Desintegración de cierta cantidad de
un radionucleido en determinado estado de energía en
determinado tiempo, por intervalo de tiempo, en determinado
momento. (Glosario de términos sobre baterías)
Agua desionizada o desmineralizada: El agua que no
presenta interferencia en las determinaciones de los
constituyentes que se van a analizar. (Glosario de
términos sobre baterías)
Almacenamiento: Acción de almacenar, reunir,
conservar, guardar o depositar sustancias, residuos y desechos
peligrosos en bodegas, almacenes o
contenedores, bajo las condiciones adecuadas. (Glosario de
términos sobre baterías)
Batería: Aparato electroquímico que
suministra energía eléctrica a partir de la
utilización controlada de reacciones químicas.
Algunas utilizan reacciones químicas reversibles y pueden
ser recargadas, como las de plomo; otras utilizan reacciones no
reversibles y no tienen más que una vida útil.
(Glosario de términos sobre baterías)
Capacidad del acumulador: Cantidad de electricidad que
el acumulador puede producir antes de que el voltaje se reduzca a
un nivel inferior al límite de una carga de diez horas. La
capacidad se expresa en amperios/hora (Ah). (Glosario de
términos sobre baterías)
Carga: Operación mediante la cual una fuente
externa suministra energía eléctrica que se
convierte en energía química en el acumulador.
(Glosario de términos sobre baterías)
Chatarra de origen: Materiales de chatarra generados in
situ que no contienen pinturas ni recubrimientos sólidos.
(Glosario de términos sobre baterías)
Chatarra pronta: Chatarra que resulta de operaciones de
manufactura o fabricación. (Glosario de términos
sobre baterías)
Chatarra de producción: Materiales de chatarra
generados in situ mediante fundición, extrusión,
laminado, separación, forjado, moldeado/estampado, corte y
recorte, y que no contienen pintura ni
revestimientos sólidos, pero no materiales de chatarra
generados mediante torneadura, perforación, laminado y
similares operaciones de maquinado, que se realimentan
directamente en la operación. (Glosario de términos
sobre baterías)
Célula, o célula electroquímica:
Se trata de un generador eléctrico constituido por no
menos de dos reacciones electroquímicas (llamadas
reacciones semicelulares), una de los cuales es de carácter reductor y la otra de
carácter oxidante. (Glosario de términos sobre
baterías)
Ceniza:
a) Materiales que quedan como residuos de procesos
pirometalúrgicos, como combustión de carbón
o incineración de películas fotográficas,
tableros de circuitos,
alambres de cobre, etc.,
que pueden reciclarse para aprovechar su contenido de metales no
ferrosos.
b) Capa superior del metal fundido, como el plomo y el zinc
que se han oxidado en contacto con el aire. Al ser espumada, la
ceniza es una mezcla limpia del metal y su óxido, y por lo
tanto un material adecuado para el reciclado. (Glosario de
términos sobre baterías)
Cenizas acumuladas: Residuos de combustiones no
transportados por el aire, provenientes de la incineración
de combustibles y otros materiales en un incinerador. El material
se deposita en el fondo del incinerador y es eliminado en forma
mecánica. (Glosario de términos sobre
baterías)
Ceniza voladora: Partículas finamente divididas
de ceniza contenidas en los gases provenientes de
combustión. Pueden contener material quemado en forma
incompleta. Se trata frecuentemente de esferas vidriosas, pero su
estructura puede ser también cristalina, o inclusive
fibrosa. (Glosario de términos sobre baterías)
Conectores: Conductores de plomo metálico
utilizados para interconectar no sólo las distintas
placas, formando elementos, sino también los elementos
entre sí para formar el circuito eléctrico interno.
(Glosario de términos sobre baterías)
Confinamiento: Depositar definitivamente los desechos
peligrosos en sitios y condiciones adecuadas, para minimizar los
impactos negativos a la salud humana y el ambiente.
(Glosario de términos sobre baterías)
Electrolito: Conductor iónico en que se sumergen
las placas. En los acumuladores de plomo, el electrolito es una
solución de ácido sulfúrico diluido al 36%
por peso (400 g de ácido sulfúrico por litro de
agua destilada). La carga de un acumulador está
determinada por la gravedad específica o densidad de su
electrolito: un acumulador totalmente cargado tiene un
electrolito con una densidad de 1,270 kg/m3. (Glosario de
términos sobre baterías)
Generador: Toda persona natural o
jurídica que a consecuencia de la manipulación o de
los procesos que realicen, produzcan residuos o desechos
peligrosos. (Glosario de términos sobre
baterías)
Nominal: Hay dos tipos de voltaje nominal:
a) voltaje nominal de la célula:
Es el voltaje que puede proporcionar la reacción
química utilizada en el acumulador, lo que en el caso de
las reacciones de los acumuladores de plomo equivale a 2 V; b)
voltaje nominal del acumulador: Es una función del
número de células
conectadas en serie; los acumuladores de los automóviles
generalmente tienen seis células en serie. (Glosario de
términos sobre baterías)
CAPÍTULO III
Marco
metodológico
3.1 Nivel de Investigación
Esta investigación se ubicará en un nivel
descriptivo, el cual consiste en la caracterización de un
hecho, fenómeno o grupo con el
fin de establecer su estructura o comportamiento.
Según Hurtado, J. (2000), se establece que para dar
respuestas a los diferentes objetivos de una
investigación, ésta debe estar enmarcada en los
criterios que permitan definir la manera de cómo se
recolecta la información, lo cual sirve de base para la
delimitación de la investigación.(p.45).
3.2 Diseño de Investigación
El diseño de investigación constituye el
plan general
del investigador para obtener respuestas a sus interrogantes o
comprobar la hipótesis de investigación, desglosa
las estrategias
básicas que el investigador adopta para generar
información exacta e interpretable. Los métodos
utilizados en el diseño fueron el análisis, la síntesis
de manera inductiva y deductiva. Esta investigación se
enmarca en el diseño documental o
bibliográfico.
El autor Tamayo, M. (1997) la define como sigue:
Es cuando recurrimos a la utilización de datos
secundarios, es decir, aquellos que han sido obtenidos por otros
y nos llegan elaborados y procesados de acuerdo con los fines de
quienes inicialmente los elaboran y manejan y por lo cual decimos
que es un diseño bibliográfico. (p.70).
Por lo tanto este diseño centra su atención en la utilización de una
estrategia basada
en el análisis de datos obtenidos de libros,
informes de
investigación, monografías, etc.
3.3 Técnica de Recolección de los
datos
Se utilizó la técnica de observación documental, que según
Tamayo y otros (1996) señala "el paso de investigaciones
que acude a fuentes directas de información, visitas a
bibliotecas,
sitios de interés donde pueda obtenerse a
información requerida para la continuación de una
bibliografía general
sobre, el tema (pág. 130).
Asimismo se usó el fichaje, el cual es una
técnica manejada especialmente por los investigadores.
Sabino (1997) la define como sigue: "Es un modo de recolectar y
almacenar información, cada ficha contiene una serie de
datos extensión variable pero todos referidos a un mismo
tema, lo cual le confiere unidad y valor propio. (p. 12). El
fichaje se realiza de manera eficiente, a la cual se le incluye
en su contenido descriptivo todos los datos de los libros que
sean necesarios para citarlo.
3.4 Técnicas de procesamiento de los datos
La técnica utilizada en el desarrollo de esta
investigación es el fichaje, la cual es una técnica
manejada especialmente por los investigadores.
3.5 Análisis e Interpretación de los Datos
Para analizar estos datos, alusivos a esta
investigación se realizara a través de este
procedimiento:
Fase I:
Una vez conocido el campo del estudio y definidos sus
límites de forma más aproximada, estaremos en
condiciones de establecer el campo de búsqueda de
información bibliográfica: de qué se
partirá, dónde se puede encontrar, con qué
instrumentos vamos a contar en primer lugar. Esta fase
comenzó por establecer las bibliotecas, centros de
documentación y bases de datos en
las que comenzará la búsqueda especializada de
carácter más genérico y cuáles
serán los primeros instrumentos de búsqueda,
revisando literatura sobre el tema de
acumuladores.
Fase II:
A partir de este momento, la búsqueda
bibliográfica se especializa y define: ya no se trata
tanto de encontrar documentación exhaustiva sobre el
particular, sino de conseguir información pertinente sobre
aspectos concretos del tema de estudio, vacíos que es
necesario salvar o datos que apoyen la investigación. En
esta fase a son válidas todas las fuentes de
información bibliográfica y de hecho se
deberán emplear todo tipo de instrumentos:
identificación de documentos,
Instrumentos para la localización de los documentos:
guías, directorios y catálogos de bibliotecas y
archivos, etc.
e instrumentos de apoyo a la investigación: obras
generales, diccionarios,
enciclopedias, libros de estilo, etc.
Fase III:
Se elaboraron las fichas de
trabajo. La elaboración de fichas es una tarea
imprescindible para el trabajo de
investigación, sea este del tipo que sea. Lo que no puede
determinarse porque en este aspecto intervienen el tipo de
trabajo desarrollado, la materia estudiada, la forma de
plantearse las estrategias de información e incluso el
propio gusto personal es la
forma y estructura de las fichas ni el soporte utilizado.
CAPÍTULO IV
Análisis de
los resultados
4.1 Elementos que intervienen en el proceso de
transformación de energía química y
eléctrica
La experiencia demuestra que conforme la energía va
siendo utilizada para promover cambios en la materia va perdiendo
capacidad para ser empleada nuevamente. El principio de la
conservación de la energía hace referencia a la
cantidad, pero no a la calidad de la
energía, la cual está relacionada con la
posibilidad de ser utilizada. Así, una cantidad de
energía concentrada en un sistema material es de mayor
calidad que otra igual en magnitud, pero que se halle
dispersa.
Aun cuando la cantidad de energía se conserva en un
proceso de transformación, su calidad disminuye. Todas las
transformaciones energéticas asociadas a cambios
materiales, acaban antes o después en energía
térmica; ésta es una forma de energía muy
repartida entre los distintos componentes de la materia, por lo
que su grado de aprovechamiento es peor. Este proceso de
pérdida progresiva de calidad se conoce como
degradación de la energía y constituye otra de las
características de esta magnitud o atributo que han
identificado los físicos para facilitar el estudio de los
sistemas materiales y de sus transformaciones.
Los generadores son dispositivos que permiten, en las
máquinas, la producción de una determinada fuerza o
energía. En el caso de un generador eléctrico, lo
que éste realiza es una mutación de la
energía. Es decir, si se encuentra con energía
mecánica – que comprende dos tipos de energía
más: la potencial y la cinética, relacionada con el
movimiento – el generador eléctrico, como su
denominación lo indica, la transforma en energía
eléctrica, que siempre se va a suscitar cuando un
conductor eléctrico establece una relación entre
dos puntos.
Por eso es que los generadores tienen, a su vez, la capacidad
de sostener lo que se llama diferencia entre el potencial
¿Qué significa esto? Que un generador establece
entre sus polos, es decir, entre sus puntos terminales, una labor
de carga de energía positiva que se traslada desde uno de
esos puntos hasta el otro. La tarea de los generadores, que es de
transformación de la energía, no puede producirse
si los conductores eléctricos no reciben el efecto que
produce el campo
magnético.
La diferencia de potencial a la que nos referimos
anteriormente solo puede mantenerse constante cuando una fuerza
electromotriz surge del movimiento entre ese campo
magnético y esos conductores eléctricos. Dentro de
la categoría mayor de generador eléctrico, hay una
subdivisión de índole primaria y secundaria. El
generador primario es el que tiene a su cargo la
transformación en energía eléctrica de otra
energía, de cualquier índole. La diferencia con el
generador secundario, es que el generador primario transforma una
energía que o bien tiene desde un comienzo o bien que
recibe para su posterior transformación. El generador
secundario, en cambio, lo que hace es entregar la
energía eléctrica que recibió
anteriormente.
El proceso de generación de energía
eléctrica es el de transformación a partir de
generadores. Y para que haya una transformación, debe
haber una fuente que se tome como base para realizar el cambio.
Dicha fuente es toda energía que sea considerada como no
eléctrica. En este grupo entran las siguientes
energías: térmica, mecánica, luminosa y
química, entre otras. Este cambio en la energía se
lleva a cabo en inmediaciones apropiadamente denominadas
centrales eléctricas, las cuales realizan tan solo los
primeros pasos del proceso. Los siguientes se corresponden ya al
suministro de la energía que ha sido generada, es decir,
todos los pormenores del transporte y la distribución.
En cuanto a esa fuente que se toma para la
transformación, se la conoce con el nombre de fuente
primaria. La naturaleza de la misma es la que va a condicionar el
tipo de central de generadores de energía. Por ejemplo, la
central termoeléctrica genera energía
eléctrica a partir de energía expulsada en forma de
calor por la combustión de gas o petróleo,
por mencionar algunos ejemplos.
En el caso de la central generadora nuclear, en la misma se
ejecuta el proceso de transformación de energía
nuclear en energía eléctrica. En las centrales
eólicas se utiliza la energía cinética que
genera la corriente de aire; en las centrales mareomotrices, la
energía que surge de las mareas, etc. Pero a pesar de las
diferencias en el rasgo distintivo de la fuente primaria, todas
estas centrales que poseen generadores de energía
eléctrica tienen en su haber, como dispositivo clave, el
elemento generador de energía. El mismo está
formado, básicamente, por un alternador. Se trata de una
máquina que es la que termina de realizar la
transformación de la fuente o energía primaria en
energía eléctrica. El proceso que emplea es el de
inducción, que produce el voltaje,
también llamado fuerza electromotriz.
Lo que se genera a través de la inducción es una
corriente eléctrica cuya magnitud y dirección están en permanente
variación cíclica. A esta corriente se la conoce
con el nombre de corriente
alterna. El alternador, entonces, siempre debe contar con un
elemento inductor generador del campo magnético y un
elemento pasivo, sometido, inducido, que siempre estará
atravesado de par en par por las fuerzas emanadas del campo
magnético. Cabe mencionar que el alternador no
podrá funcionar sin la acción de una máquina
de fluido, comúnmente conocida como turbina, que va a
fluctuar en sus características según las
características de la energía primaria que se
va a transformar, de ahí que haya una turbina especial
para cada central que posea generadores de energía
eléctrica.
4.2 Componentes que posee una batería de
automóvil vinculados al proceso de transformación
de energía química en energía
eléctrica
Las baterías de ácido de plomo tienen un voltaje
nominal de alrededor de dos voltios. La mayoría de
baterías de coche se componen de seis celdas y por ello
tienen una tensión de doce voltios. El
voltaje que se da en el chispazo de las típicas
baterías es de 1,5 voltios.
Las baterías más usadas son las de Plomo-Acido,
Estas baterías deben estar diseñadas para
suministrar una gran corriente durante un periodo de tiempo
corto. Suelen tener una vida útil de unos 4-5 años,
y esta está estrechamente ligada con la profundidad de
descarga a la cual se ve sometida es decir a cuanta
energía sobre su capacidad nominal se le "pide" sobre su
capacidad nominal, en cada ciclo de carga y descarga. En
las baterías de Plomo-Acido, la vida útil
será mayor cuanto menor sea la descarga de estas
baterías en cada ciclo de carga-descarga.
Las capacidad de una batería viene medida en Amperios
por hora (A.h) que es la cantidad de corriente de descarga
disponible durante un tiempo determinado. Pero esta capacidad es
válida solamente para una temperatura específica y
profundidad de descarga.
Regulador de carga: Sumisión es preservar la vida de
las baterías para evitar situaciones de sobrecarga y
sobredescarga a fin de alargar la vida de estas. Por lo tanto
controlará los procesos de carga y descarga de la
batería en función de la generación y el
consumo de la energía. Las baterías de ácido
de plomo tienen un voltaje nominal de alrededor de dos voltios.
La mayoría de baterías de coche se componen de seis
celdas y por ello tienen una tensión de doce voltios.
A pesar del gran esfuerzo realizado en investigación de
los diferentes tipos de materiales las baterías de plomo
ácido son las preferidas e insuperables por el amplio de
aplicaciones que tienen. El plomo es abundante y no demasiado
caro y es por esta razón por la cual es idóneo para
la producción de baterías de buena calidad en
grandes cantidades.
Las primeras baterías de plomo-ácido
(acumuladores de plomo), fueron fabricadas a mediados del siglo
XIX por Gaston Planté. Hoy en día todavía
son uno de los tipos de baterías más comunes. Se
descubrió que cuando el material de plomo se
sumergía en una solución de ácido
sulfúrico se producía un voltaje eléctrico
el cual podía ser recargado. Este tipo de baterías
es único en cuanto que utiliza el plomo, material
relativamente barato, tanto para la placa positiva como para la
negativa. El material activo de la placa positiva es óxido
de plomo (PbO2). El de la placa negativa es plomo puro esponjoso
y el electrolito está disuelto en (H2SO4). Cuando hablamos
de material activo en las baterías de ácido de
plomo,nos referimos al óxido de plomo y al plomo
esponjoso.
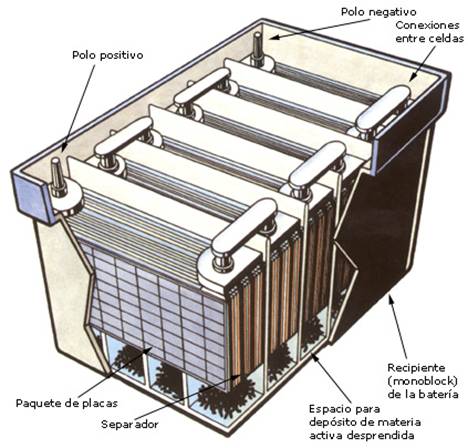
Partes del Acumulador o Bateria
1. Carcasa: cuerpo físico del acumulador.
2. Rampa: sello entre la tapa y la carcaza.
3. Empuñadura: (opcional).
4. Borne positivo: de donde sale la corriente a los
dispositivos.5. Recipiente: contenedor de las placas.
6. Fijación: pequeña pestaña
para evitar movimientos.7. Placas negativas: mantienen cerrado el
circuito.8. Placas positivas: envían corriente
eléctrica al borne positivo.9. Separadores: mantienen aisladas las placas
positivas de las negativas.10. Rejilla: soportes de la materia activa.
4.3 Proceso de transformación de energía
química a energía eléctrica en una
batería de automóvil
Las baterías de acumuladores eléctricos de
plomo-ácido sulfúrico almacenan energía
química durante la operación de carga y la
devuelven en forma de energía eléctrica para su
aprovechamiento en distintas aplicaciones. Una batería
está constituida por un recipiente que contiene un
conjunto de elementos formados de placas positivas y negativas
sumergidas en un electrolito que es una disolución de
ácido sulfúrico en agua. Una batería se
caracteriza por su capacidad de almacenamiento de energía
eléctrica en amperios hora (A-h) y su voltaje en voltios
(V). Las más usuales son de 12 V y con varias capacidades
según el uso a que estén destinadas. Conectadas en
serie se obtienen los voltajes requeridos. Se emplean como fuente
de energía eléctrica en vehículos de
transporte, maquinaria de obras públicas, carretillas
elevadoras, grupos electrógenos, centrales
eléctricas, etc. Después de un determinado tiempo
de uso agotan su carga y requieren una recarga. Esta
operación puede repetirse muchas veces y se debe realizar
en condiciones de seguridad.
La batería tiene un determinado numero de celdas,
unidas por medio de barras metálicas, cada celda acumula
algo mas de dos voltios. Las baterías para
automóviles tienen 6 celdas, que unidas dan un total
de 12 voltios.
Cada celda, consta de dos juegos de
placas, o electrodos inmersos en una solución de
agua y acido sulfúrico llamado electrolito. Un juego de
placas esta hecho de peroxido de plomo y el otro, de plomo
poroso.

Al funcionar la celda, el acido reacciona y convierte la
energía química en energía eléctrica.
En las placas de peroxido de plomo se genera carga positiva (+) y
en las de plomo poroso carga negativa (-).La corriente
eléctrica, que se mide en amperios circula por el sistema
eléctrico desde un terminal de la batería hasta el
otro, activando el electrolito.
Conforme continua la reacción química, se forma
sulfato de plomo en la superficie de ambos juegos de placas, y el
acido sulfúrico se diluye gradualmente. Cuando la
superficie de ambos juegos de placas se cubre completamente con
el sulfato de plomo, se descarga la batería. Al recargarlo
con una corriente eléctrica, las placas vuelven a su
estado original, y el acido sulfúrico se regenera.
Con el tiempo, las baterías dejan de funcionar, y no se
pueden recargar, debido a que las placas están cubiertas,
con una capa de sulfato, tan gruesa que la carga no pasa a
través de ellas; o bien las placas se desintegran; o hay
fugas de corriente entre las placas de la celda, lo que puede
provocar un cortocircuito.
La energía eléctrica se almacena y se produce
por dos placas metálicas sumergidas en una solución
química (electrolito) a mayor superficie de las placas se
almacena mas energía.




Los separadores porosos no son conductores, y evitan
cortocircuitos, cada grupo forma una celda con un voltaje algo
superior a los 2 voltios. El voltaje de cada celda es el
mismo sin importar su tamaño y el número de
placas. Para lograr voltajes mas altos las celdas se deben
conectar en serie ( por ejemplo 6 celdas producirán
12 voltios)
Para arrancar el motor, se necesita la máxima corriente
de la batería; en el corto periodo en que funciona el
motor de arranque, puede consumir hasta 400 amperes; debido a
este alto consumo no se debe hacer funcionar el motor de arranque
mas de 30 segundos continuos; debe dejarse un minuto
de intervalo para reducir la posibilidad de una descarga
total, de la batería, o un sobrecalentamiento en las
partes internas del motor de arranque. Un motor grande necesita,
mínimo una batería de 400 Amperes para
arrancar, y un motor pequeño solo necesita uno de 250
A.
Funcionamiento
La materia activa positiva es peróxido de plomo, en
cambio la materia activa negativa es plomo esponjoso, y el
electrolito como ya mencionamos es ácido sulfúrico,
al conectar un consumo de corriente se cierra el circuito entre
la placa positiva y la negativa, efectuándose las
siguientes reacciones químicas:
1. El peróxido de plomo de la placa positiva
se combina con el ácido sulfúrico
transformándose en sulfato de plomo y
liberándose hidrógeno y oxígeno
admitiendo electrones del circuito exterior.2. El plomo de la placa negativa se combina con el
ácido sulfúrico formándose sulfato de
plomo y liberándose hidrógeno, cediendo
electrones al circuito exterior3. El hidrógeno y el oxígeno liberados
se combinan para formar agua. Durante este proceso de
descarga el electrolito disminuye la densidad por el consumo
de ácido sulfúrico. Los electrones admitidos
por una placa y cedidos por la otra, constituyen la corriente
del circuito exterior.
CAPÍTULO V
Conclusiones y
recomendaciones
5.1 Conclusiones
Al estudiar las diversas formas de energía, los
científicos han descubierto que la energía es
siempre la misma pero que se presenta de diversas maneras y que,
mediante dispositivos apropiados, puede transformarse de una
forma a otra forma distinta. En la casa puedes observar la
transformación de la energía eléctrica en
otras formas. Una estufa la transforma en energía
calorífica; un bombillo, en energía luminosa y
calorífica; un motor, en energía cinética;
las bocinas de tu tocadiscos transforman la energía
eléctrica en energía sonora.
La energía química está relacionada con
la forma como los átomos se enlazan unos con otros para
formar las moléculas de los cuerpos. Al romperse esos
enlaces por combustión aparecen los efectos de la
energía química. La gasolina, el gasoil, el
carbón, el gas natural son
substancias que al quemarse liberan la energía que
almacenan. Las plantas verdes
usan y almacenan la energía
solar para su desarrollo. Cuando comemos, la energía
almacenada en los alimentos se
manifiesta en nuestro interior como calor y capacidad de
movimiento. Todos esos cambios son procesos químicos. Las
baterías de los carros y las pilas de linterna almacenan
también energía química que se transforma en
energía eléctrica, cinética o luminosa
mediante un dispositivo adecuado.
La Energía eléctrica por su parte, es, tal vez,
la forma de energía con la que estamos más
familiarizados por el uso constante de los aparatos
eléctricos en la casa. Los diversos bombillos y
lámparas, el televisor y la radio, la
licuadora, la tostadora, un secador de pelo, un plancha
eléctrica, son algunos de los aparatos de uso diario. Su
uso está muy generalizado porque es muy fácil
convertirla a otra forma de energía. La energía
eléctrica que llega a las casas se convierte, mediante
dispositivos apropiados, en luz (energía luminosa), en
movimiento (energía cinética), en sonido
(energía sonora), en calor (energía
térmica).
La batería como comúnmente se le llama es un
elemento acumulador de energía que la recibe en forma
eléctrica y la almacena en forma química, en el
proceso de descarga se toma la energía de la
batería que es transformada nuevamente en eléctrica
y será la encargada de suministrarla a los consumidores
eléctricos. Se entiende la batería como una fuente
de energía independiente del motor de combustión
interna, que en caso de necesidad como cuando se encuentra
detenido el motor, abastece de energía eléctrica a
ciertos consumidores como lo es el motor de arranque "Marcha", la
bobina de encendido y el alumbrado. Cuando el motor esta en
marcha la batería acumula parte de la energía
suministrada por un generador de corriente llamado
alternador.
Para el funcionamiento de la batería para
automóviles, por ejemplo, el proceso es el siguiente: 1.
Descarga. Cuando se permite circular una corriente externas entre
los terminales positivos y negativos las placas de plomo y oxido
de plomo se van transformando en sulfato de plomo y liberando
agua en el proceso. 2. Cuando se forza una corriente externa
hacia en sentido contrario la placa positiva de sulfato de plomo
se transforma nuevamente en plomo mientras que la negativa en
oxido de plomo. Además la concentración de acido
vuelve a ser mayor.
Durante la primera etapa toda la energía se convierte
en energía almacenada química (mas eficiente). En
la segunda etapa parte de la energía eléctrica
suministrada se utiliza para la electrolisis del agua produciendo
gases (oxigeno e
hidrogeno) y
es menos eficiente. En esta ultima etapa el voltaje no aumenta
mas y toda la energía suministrada se utiliza para la
electrolisis del agua. Este voltaje que se alcanza aquí se
conoce como voltaje final de carga.
5.2 Recomendaciones
Es importante mantener en buen estado el acumulador del
vehículo, sea cual fuere el uso que se le esta
dando.Un acumulador en buenas condiciones que se está
descargando constantemente puede deberse a:
* Bandas del generador o alternador desgastadas, sueltas o muy
lentas.
* Corto circuito en el sistema eléctrico del
vehículo.
* Regulador de voltaje defectuoso o ajustado
indebidamente.
* Corto circuito en el sistema de luces.
* Generador o alternador defectuoso.
* El automóvil no se ha utilizado en un largo
periodo.
* Se dejaron encendidos accesorios eléctricos:
estéreos, luces, etc.
Realizar actividades educativas que fomenten el desarrollo
de la investigación para la producción de
generadores eléctricos que impulsen el desarrollo y
diversificación de la economía venezolana.
Bibliografía
Constitución de la República
Bolivariana de Venezuela. 1999.
Enciclopedia Encarta 2007.
Hurtado, J. (2000), Metodología de la Investigación. Mc
Graw Hill. México.
Ley Orgánica de Hidrocarburos. Venezuela 1999.
Tamayo, Mario (1997). El proceso de la investigación científica. Editorial
Panapo. Venezuela.
Sabino, Carlos. (1996). El proceso de la Investigación
Científica. Panapo Editores. Caracas, Venezuela.
www.daedalus.es/inteligencia-de-negocio/sistemas-complejos/ingenieria-de-sistemas
es.wikipedia.org/wiki/Batería_eléctrica
http://docencia.udea.edu.co/cen/electroquimicaII/sistemas/sistemas_almacenamiento_energia.pdf
http://www.mintra.gov.ve/legal/leyesorganicas/leydehidrocarburo.html
www.wikipedia.com
Autor:
Pablo A. Loreto M.
Roberto V. Figuera
Nicmar M. Torrellas R.
Joslina V. Perdomo T.
Félix A. Morillo R.
Ciudad Bolívar –
Venezuela, Junio de 2009.
UNIVERSIDAD
"GRAN MARISCAL DE AYACUCHO"
FACULTAD DE INGENIERIA
ESCUELA DE INGENIERIA DE SISTEMAS
CIUDAD BOLÍVAR

 Página anterior Página anterior |   Volver al principio del trabajo Volver al principio del trabajo | Página siguiente  |
