- Introducción
- Conductores de corriente
eléctrica - Electrólitos
- Ionización
- Corriente
eléctrica y movimiento de iones - Reacciones de
electrodo - Celda
voltaica - Aplicaciones
industriales - Tratamientos
anticorrosivos de superficie - Galvanotecnia
- Protección
catódica
Introducción
Es la parte de la química que trata de
la relación entre las corrientes eléctricas y las
reacciones
químicas, y de la conversión de la
energía química en eléctrica y viceversa. En
un sentido más amplio, la electroquímica es el estudio de las
reacciones químicas que producen efectos eléctricos
y de los fenómenos químicos causados por la
acción
de las corrientes o voltajes.
Conductores de
Corriente Eléctrica
Cualquier material que ofrezca poca
resistencia al
flujo de electricidad se
denomina conductor eléctrico, como las disoluciones
de la mayoría de los ácidos
inorgánicos, bases y sales son buenos conductoras de la
electricidad y todo material que impida el paso de la corriente
eléctrica es denominado mal conductor o
aislador eléctrico, como las disoluciones de
azúcar,
alcohol,
glicerina y muchas otras sustancias orgánicas. La
diferencia entre un conductor y un aislante, es de grado
más que de tipo, ya que todas las sustancias conducen
electricidad en mayor o en menor medida. Un buen conductor de
electricidad, como la plata o el cobre, puede
tener una conductividad mil millones de veces superior a la de un
buen aislante, como el vidrio o la mica.
En los conductores sólidos la corriente eléctrica
es transportada por el movimiento de
los electrones; y en disoluciones y gases, lo hace
por los iones.
Los conductores se clasifican
en:
a) Conductores de 1° clase: son
aquellos que dejan fluir la electricidad sin sufrir
alteración, como los metales.
b) Conductores de 2° clase o
electrólitos: son aquellos que se ionizan y entonces
conducen la corriente eléctrica, como las soluciones
acuosas de ácidos, bases y sales, así
también las sales fundidas. Los electrólitos a su
vez se clasifican en:
I) Fuertes: Los electrólitos
que proporcionan disoluciones altamente conductoras se llaman
electrólitos fuertes (como el ácido
nítrico o el cloruro de sodio).
II) Débiles: Los que producen
disoluciones de baja conductividad reciben el nombre de
electrólitos débiles como el cloruro
mercurioso (HgCl2) o el ácido etanoico
(CH3-COOH).

Electrólitos
Los ácidos, sales las bases y las
sales sólidas son malos conductores de la electricidad,
pero cuando cualquiera de estas sustancias se disuelve en
agua,la
solución resultante es conductora.
Cuando una de estas sustancias se disuelve
en agua (o se funde) se disocian en partículas con carga
eléctrica (positiva o negativa) llamadas iones y a
la disociación en iones se la denomina
ionización. Así un ion se define como
átomo o grupo de
átomos con carga eléctrica. Un átomo que
pierde un electrón forma un ion de carga positiva, llamado
catión; un átomo que gana un electrón
forma un ion de carga negativa, llamado
anión.
Cualquier sustancia que produce iones en
solución es un electrólito. Las sales son
iónicas aún en estado
sólido, pero cuando se disuelven o se funden, los iones se
separan y adquieren libertad de
movimiento. La conducción electrolítica se debe a
la movilidad iónica en estado líquido.
Ionización
Al combinarse sodio con cloro, para formar
cloruro de sodio, cada átomo de sodio cede un
electrón a un átomo de cloro,dando como resultado
un ion sodio con carga positiva y un ion cloro con carga
negativa.
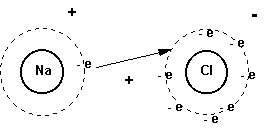
Figura 1
Cl2 ° + 2.Na ° ® 2.NaCl
En un cristal de cloruro de sodio la fuerte
atracción electrostática entre iones de cargas
opuestas mantiene firmemente los iones en su sitio,
estableciéndose un enlace iónico. Cuando el
cloruro de sodio se disuelve en agua, los iones se disocian y
pueden moverse libremente.
NaCl ® Na+ + Cl-
Cuando se disuelve cloruro de sodio en
agua, los iones se disocian (por la atracción entre los
iones y el disolvente), y esta disolución es un excelente
conductor de la electricidad.
Página siguiente  |
