- Métodos
potenciométricos - Electrodos de
Referencia - Electrodo de
Calomel - Electrodo de
referencia de calomel típico - Electrodo de
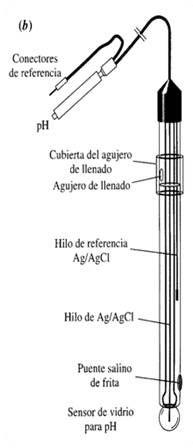
Plata-Cloruro de Plata - Potencial de
unión líquida - Electrodos
indicadores - Electrodos
Indicadores Metálicos - Electrodos
indicadores de membrana - Electrodos para la
medida de Ph - Error
Alcalino - Error
Ácido - Electrodos
sensibles a los gases - Características
generales del estudio de muestras por
potenciometría - Técnicas
Potenciométricas - Preparación
de muestras y límites de
detección - Limitaciones
Generales - Sensibilidad
- Conclusiones
- Bibliografía
Introducción
Los métodos
potenciométricos se basan en la medición del potencial en
una celda electroquímica sin paso de
corriente apreciable. En base a ello, se puede utilizar la
potenciometría para determinar puntos finales de
valoraciones. Más recientemente, las concentraciones
iónicas selectivas se miden a través del uso de
electrodos de membrana diseñados
específicamente.
Está técnica es usada ampliamente. Ofrece
varias ventajas por encima del resto de los métodos
analíticos. Los electrodos estás considerablemente
libre de interferencias, es más económico rápido y
seguro. Por ello, en los
últimos tiempos estos métodos han prácticamente
desplazado a los demás en muchos tipos de
estudios.
También resultan muy útiles en la
determinación de las constantes fundamentales de reacciones químicas, como
las constantes de equilibrio. Fundamentalmente,
el método se basa en La
disposición de dos electrodos, uno de referencia y uno
indicador, y un dispositivo de medida de potencial. Estos al
trabajar en conjunto pueden realizar una medida ajustada del
potencial de una celda con respecto a un valor de referencia. Esta
información está
íntimamente ligada a la concentración de las especies
iónicas en la solución por medio de la ecuación de
Nernst.
Entre las aplicaciones más comunes de la
potenciometría están los estudios de contaminantes en
las aguas urbanas, la caracterización físico química de productos de consumo humano, titulaciones
potenciométricas, etc.
Métodos
potenciométricos
La potenciometría es una técnica
electroanalítica con la que se puede determinar la
concentración de una especie electroactiva en una
disolución empleando un electrodo de referencia (un
electrodo con un potencial constante con el tiempo y conocido) y un
electrodo de trabajo (un electrodo sensible
a la especie electroactiva).
Mediante el siguiente diagrama que describe una
celda típica para estudios potenciométricos, se
detallarán cada una de las partes en un equipo de
potenciometría y sus funciones.
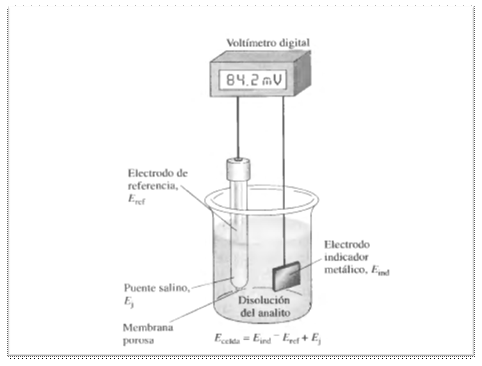
Celda para medidas
potenciométricas.
El diagrama de funcionamiento de la celda sería el
siguiente:

El electrodo de referencia en este diagrama es una
semicelda cuyo potencial de electrodo Eref se conoce con
exactitud y es independiente de la concentración del analito
u otros iones en la disolución de estudio. Aunque puede
tratarse de un electrodo normal de hidrógeno, este se usa
pocas veces ya que su empleo y mantenimiento es algo
problemático. Por convenio, el electrodo de referencia
siempre se usa como el de la izquierda en las medidas
potenciométricas. El electrodo indicador que se sumerge en
la disolución del analíto, adquiere un potencial Eind,
que depende de la actividad del analito. Muchos electrodos que se
emplean en potenbciometría son selectivos en sus respuestas.
El tercer componente en una celda potenciométrica es el
puente salino, el cual impide que los componentes de la
disolución del analito se mezclen con el electrodo de
referencia. En la superficie de cada extremo del puente salino se
desarrolla un potencial de unión líquida. Estos dos
potenciales tienden a anularse mutuamente si las movilidades del
catión y el anión son casi iguales. El cloruro de
potasio es un electrolito para el puente salino casi ideal,
puesto que las movilidades del K+ y el Cl-, es prácticamente
idéntica. Por tanto el potencial a lo largo del puente
salino, se reduce a unos pocos milivoltios. En muchos
métodos electro analíticos el potencial de unión
es suficientemente pequeño para no tenerse en cuenta. Sin
embargo en los, métodos potenciométricos, el potencial
de unión y su incertidumbre pueden ser factores que afecten
la exactitud y precisión de la medida.
Página siguiente  |
