Introducción
El hierro es un elemento químico de
número atómico 26 situado en el grupo 8,
periodo 4 de la tabla
periódica de los elementos. Su símbolo es
Fe (del latin ferrum) y tiene una masa
atómica de 55,6 u. Este metal de transición es
el cuarto elemento más abundante en la corteza terrestre,
representando un 5%. Es un metal maleable, de color gris
plateado y presenta propiedades magnéticas; es
ferromagnético a temperatura
ambiente y
presión
atmosférica.
Es uno de los elementos más importantes del Universo, y el
núcleo de la Tierra
está formado principalmente por hierro y
níquel, generando al moverse un campo
magnético. Ha sido históricamente muy
importante, y un período de la historia recibe el nombre de
Edad de Hierro.
Investigación del
hierro
Es el elemento más pesado que se produce
exotérmicamente por fusión,
y el más ligero que se produce a través de una
fisión, debido a que su núcleo tiene la más
alta energía de enlace por nucleón (energía
necesaria para separar del núcleo un neutrón o un
protón); por lo tanto, el núcleo más estable
es el del hierro-56 (con 30 neutrones).
Presenta diferentes formas estructurales dependiendo de la
temperatura y presión. A presión
atmosférica:
Hierro-(: estable hasta los 911 °C. El sistema
cristalino es una red cúbica centrada en el
cuerpo.Hierro-(: 911 °C – 1392 °C; presenta una red
cúbica centrada en las caras.Hierro-(: 1392 °C – 1539 °C; vuelve a presentar
una red cúbica centrada en el cuerpo.Hierro-(: Puede estabilizarse a altas presiones, presenta
estructura hexagonal compacta .
El hierro es el metal más usado, con el 95% en peso de
la producción mundial de metal. El hierro puro
no tiene demasiadas aplicaciones, salvo excepciones para utilizar
su potencial magnético. El hierro tiene su gran
aplicación para formar los productos
siderúrgicos, utilizando éste como elemento
matriz para
alojar otros elementos aleantes tanto metálicos como no
metálicos, que confieren distintas propiedades al
material. Las aleaciones
férreas presentan una gran variedad de propiedades
mecánicas dependiendo de su composición o el
tratamiento que se haya llevado a cabo.
Obtención del hierro
El hierro se encuentra formando parte de numerosos minerales, entre
los que destacan la hematites (Fe2O3), la magnetita (Fe3O4), la
limonita (FeO (OH)), la siderita (FeCO3), la pirita (FeS2), la
ilmenita (FeTiO3), etc.
Se puede obtener hierro a partir de los óxidos con
más o menos impurezas.
El mineral extraído de una mina de hierro puede
ser de carga directa a los altos hornos o puede requerir de un
proceso de
peletización para ser utilizado en la producción
del acero, esto
según sea su calidad.
En primer lugar vamos a explicar la extracción del
mineral de carga directa a los altos hornos.
El alto horno es la instalación industrial
dónde se transforma o trabaja el mineral de hierro. Un
alto horno típico está formado por una
cápsula cilíndrica de acero de unos 30 m de alto
forrada con un material no metálico y resistente al
calor, como
ladrillos refractarios. El diámetro de la cápsula
disminuye hacia arriba y hacia abajo, y es máximo en un
punto situado aproximadamente a una cuarta parte de su altura
total. La parte inferior del horno está dotada de varias
aberturas tubulares llamadas toberas, por donde se fuerza el paso
del aire que
enciende el coque. Cerca del fondo se encuentra un orificio por
el que fluye el arrabio cuando se sangra (o vacía) el alto
horno. Encima de ese orificio, pero debajo de las toberas, hay
otro agujero para retirar la escoria. La parte superior del horno
contiene respiraderos para los gases de
escape, y un par de tolvas redondas, cerradas por válvulas
en forma de campana, por las que se introduce el mineral de
hierro, el coque y la caliza.
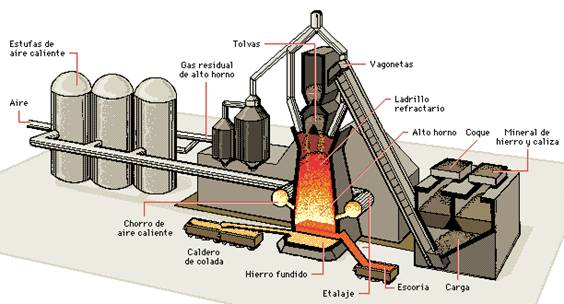
FIGURA 1
Lo que ocurre en dicho horno es lo siguiente:
Los gases sufren una serie de reacciones; el coque puede
reaccionar con el oxígeno
para formar dióxido de carbono:
C + O2 CO2
CO2
A su vez el dióxido de carbono puede reducirse para dar
monóxido de carbono:
CO2 + C  2CO
2CO
Página siguiente  |
