Vigilancia del dengue basada en el laboratorio: diferencias en el número de casos y virus aislados según la recolección del suero y la prueba serológica (página 2)
MATERIALES Y MÉTODOS
Casos. Se incluyeron 655
casos febriles con sospecha clínica de dengue de los
ocurridos en Santander en los años 2000, 2003 y 2004. En
estos años el sistema de
vigilancia local no informó de brotes7,16. Los
pacientes se seleccionaron si presentaban fiebre
acompañada de dos o más síntomas como dolor
de cabeza, dolor retro-orbital, mialgias, artralgias,
erupción cutánea, y con o sin manifestaciones
hemorrágicas (petequias, epistaxis, hemoptisis o sangrado
de encías). Se excluyeron quienes tuvieron algún
foco de infección aparente como otitis, infección
urinaria, enfermedades crónicas
y otros.
Estrategias de vigilancia
1. Con sueros no-pareados. Se realizó por
el sistema de vigilancia (SIVIGILA) de Santander en el año
2000. Se incluyeron 337 casos febriles del total de informados a
la Secretaría de Salud por las instituciones
de salud que los atendieron. De cada uno se colectó un
único suero antes o después del sexto día de
síntomas y luego se remitió al Laboratorio
Departamental de Salud
Pública. En este laboratorio los sueros se almacenaron
a 4oC antes de ser procesados para detectar
anticuerpos IgM usando el estuche UMELISA DENGUE como se
describe adelante. De las sueros agudos (antes del sexto
día de síntomas) almacenados máximo 8
días, se remitió una alícuota al Laboratorio
de Virología del Centro de Investigaciones
en Enfermedades Tropicales de la Universidad
Industrial de Santander (CINTROP/UIS), para aislamiento del
virus en
cultivo de células
como se describe luego. La información sobre fecha y día de
recolección del suero se consultó en la ficha de
informe que
acompañaba la muestra.
2. Con sueros pareados. Se incluyeron 318 casos
atendidos en clínicas privadas entre los años 2003
y 2004. De cada uno se colectó un suero el día de
la consulta (hasta con 5 días de síntomas) y 10
ó 15 días después una enfermera participante
en el estudio visitó al paciente en su residencia para
colectar el suero convaleciente. Las muestras se remitieron al
Laboratorio de Virología del CINTROP/UIS en las 6 horas
siguientes a su colecta. Aquí se almacenaron a
-70oC por una semana y luego se procesaron para
detectar anticuerpos IgM usando un protocolo
estándar del MAC-ELISA y aislar el virus como se describe
adelante.
Detección de IgM
1. Estuche UMELISA DENGUE (Instituto Pedro
Kourí, La Habana, Cuba).
Según las instrucciones del fabricante el procedimiento
brevemente consistió en: 10 ml del suero se hicieron
reaccionar con un anticuerpo anti-IgM humana ligado a pozos de
tiras ultramicroELISA por 1 hora a 37oC; se hicieron 6
lavados con tampón fosfato y enseguida se adicionaron 10
ml del antígeno. Después de
incubación y lavados en las mismas condiciones, se
adicionaron 10 ml del anticuerpo conjugado con fosfatasa alcalina
(anti IgG/FA) por 1 hora a 37oC y después de
lavar se agregaron 10 ml del substrato (4-metilumberiferil
fosfato). Al término de la incubación a temperatura
ambiente por
30 min la fluorescencia se leyó en un
lector SUMA (IPK, Cuba). Los sueros con valores de
densidad
óptica
mayor o igual a 0.3 se consideraron positivos. Los autores fueron
autorizados por la Secretaría de Salud para consultar
los valores de
densidad óptica en el libro de
registros del
Laboratorio de Salud Pública.
2. MAC-ELISA. Se utilizó el
protocolo estándar18. Se sensibilizaron por 18
horas a 4ºC, microplacas de 96 pozos con 100 ml de
anticuerpo anti-IgM humana (Sigma St. Louis, MO). Después
de lavar 3 veces con tampón fosfato (PBS pH 7.4) se
adicionaron 50 ml del suero (1:40) a cada pozo y las placas se
incubaron por 2 horas a 37ºC. Después de 5 lavados se
agregaron 50 ml de antígeno por 18 horas a 4ºC y de
nuevo se lavaron y enseguida se adicionó 50 ml de
anticuerpo anti-dengue conjugado con peroxidasa (6B6C; CDC,
Dengue Branch, Puerto Rico). Las
placas se incubaron por una hora a 37ºC, se lavaron y luego
se adicionaron 100 ml del sustrato (TMB; Sigma St. Louis, MO).
La lectura se
realizó a 450 nm en un lector de ELISA (Sensident Scan
Merck) y el valor del
punto de corte se calculó como el promedio de los valores
de densidad óptica (DO) de los sueros negativos más
2 ED. Los sueros que presentaron la DO igual o mayor al punto de
corte se consideraron positivos. Cuando las dos muestras del
mismo paciente resultaron positivas, la muestra de convalecencia
se diluyó 4 veces y se hizo de nuevo el proceso. Un
resultado positivo en estos casos se consideró
infección aguda por dengue y el negativo infección
pasada reciente.
Validación del MAC-ELISA. Grupos de sueros
pareados procesados por el MAC-ELISA se analizaron también
por el UMELISA (n=28) y los estuches IgM*ELISA anti-dengue (IPK,
La Habana, Cuba) (n=55) y dengue IgM-capture ELISA (PANBIO Pty
Ltd., East Brisbane, Australia) (n=29). Las pruebas se
realizaron siguiendo el procedimiento indicado por el fabricante
similar al MAC-ELISA con diferencias en el volumen de los
reactivos y tiempo de
incubación. Con ambos estuches un resultado positivo se
consideró cuando el valor de la DO fue 2 ED del promedio
de los controles negativos.
Aislamiento del virus. Se utilizaron
sueros agudos para infectar células de mosquito Aedes
albopictus (clon C6/36) mantenidas en medio Leibozt´s
(L-15. GIBCO,BRL) suplementado con suero bovino fetal (10%),
triptosa fosfato (10%) y antibióticos (penicilina 100
UI/ml; estreptomicina 100 mg/ml) (1%). Brevemente, se adicionaron
100 ml de suero a monocapas celulares crecidas en tubos de
vidrio y luego
los cultivos se centrifugaron a 2,000 rpm por 30 min y a
temperatura ambiente. Después se adicionó 1 ml del
medio de cultivo suplementado con 2% de suero bovino fetal y los
cultivos se incubaron a 32oC por 8
días17. La presencia del virus se
determinó por inmunofluorescencia directa usando un
anticuerpo policlonal anti-dengue marcado con fluoresceína
y luego el serotipo se identificó por inmunofluorescencia
indirecta con anticuerpos monoclonales
específicos15. Los anticuerpos fueron
gentilmente donados por el CDC, Dengue Branch Puerto
Rico.
Diagnóstico del dengue.
Según el resultado de las pruebas de laboratorio, el
diagnóstico se estableció de acuerdo
con los criterios de la OMS8 como:
a. Caso confirmado: cuando se encontró
seroconversión o aumento de 4 veces el título de la
IgM y/o se aisló el virus.
b. Caso sin dengue: cuando no se encontró IgM en
suero de la convalecencia.
c. Caso probable: cuando se encontró IgM en una
sola muestra de suero y no se aisló el virus.
d. Caso no-concluyente: cuando no se encontró IgM
en el suero agudo ni se aisló el virus y cuando no se
colectó suero de la convalecencia.
e. Caso de infección pasada reciente: cuando se
encontró IgM en el suero agudo y convaleciente sin aumento
cuádruplo del título y el virus no se
aisló.
Análisis de los datos. Se
utilizó la prueba de Chicuadrado (c2) para determinar la
significancia de las diferencias en las frecuencias, utilizando
el programa Epi
Info vesión 5.0.
RESULTADOS
Detección de anticuerpos. En los casos
sospechosos la IgM se detectó con diferente frecuencia
dependiendo del suero colectado y la prueba (Cuadro 1), en 61.1%
vs. 22% de los agudos y en 86.8% vs. 49.3% de los convalecientes
analizados por el UMELISA y MAC-ELISA, respectivamente, y estas
diferencias fueron significativas (p<0.001). De acuerdo con
estos resultados se pudo establecer que 73.8% (249/337) de los
pacientes de la primera estrategia
(SIVIGILA local) fueron IgM+ en contraste con 48.7% (155/318) de
la segunda. De los 155 pacientes IgM+ de la segunda estrategia en
70 (45.1%) el anticuerpo se encontró en ambos sueros, pero
2 de estos (2.8%) no tuvieron aumento cuádruplo del
título (infecciones pasadas).

Al comparar el MAC-ELISA con las otras pruebas estos
fueron los resultados (Cuadro 2): con el estuche Dengue
IgM-capture ELISA (IPK) se obtuvo concordancia en 53 sueros
agudos (96.3%; k=0.88) y 55 convalecientes (100%; k=1) de 55
pareados, resultando 32 pacientes confirmados por ambas pruebas.
Con el de PAMBIO, de 29 pareados 27 agudos y sus convalecientes
concordaron (93.1%; k=0.86) pudiéndose confirmar el dengue
en 21 pacientes de los cuales en 2 no se logró por el
MAC-ELISA local. Con el UMELISA en 10 agudos (35.7%; k= -0.1) y
19 convalecientes (65.5%; k=0.29) de 28 pareados los resultados
fueron iguales, resultando 17 pacientes confirmados de los cuales
3 no lo fueron por la prueba local. En los casos confirmados con
cada uno de los estuches la IgM se detectó en el suero
agudo en 31.2 (10/32), 57.1 (12/21) y 100% (17/17) por el del
IPK, PANBIO y UMELISA, respectivamente.

Diagnóstico del dengue según la estrategia
de vigilancia. Usando un único suero (primera estrategia)
el dengue no se pudo confirmar por serología en
ningún de los 337 casos. De estos, 249 (73.8%) resultaron
casos probables (IgM+), en 22 (6.5%) el dengue se descartó
(IgM- en suero convaleciente) y en 66 (19.6%) el
diagnóstico no se pudo concluir (IgM- en suero agudo). En
contraste, cuando se usaron sueros pareados (segunda estrategia)
el diagnóstico se definió en los 318 casos. Esto
es, en 155 (48.7%) el dengue se confirmó, en 161 (50.6%)
se descartó y 2 (0.6%) fueron infecciones recientemente
pasadas.
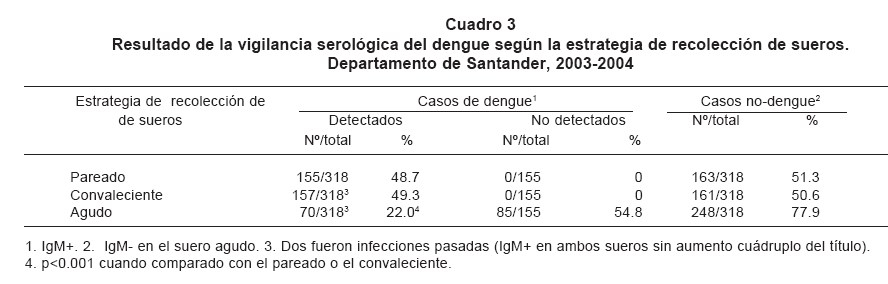
Los autores del presente artículo intentaron
hacer un análisis más preciso de la exactitud
en los datos de la vigilancia según el suero que se
analice. Para esto se comparó la frecuencia del dengue en
los 318 casos de la segunda estrategia, cuando el resultado de la
serología con sueros pareados o con un único suero
(agudo o convaleciente) es el que se considera (Cuadro 3). Con
muestras pareadas 155 (48.7%) fueron casos de dengue (IgM+), pero
con suero de la convalecencia fueron 157 (49.3%) porque se
incluyen las 2 personas con infección pasada reciente. En
contraste, cuando se utiliza la serología en suero agudo
el número de casos disminuyó de 155 a 70 (22%)
porque se excluyeron 85 (54.8%) que resultaron IgM+ en la
convalecencia y esta disminución fue significativa
(p<0.001).
Aislamiento del virus. Se intentó de 170 y 236
sueros de la primera y segunda estrategia, respectivamente
(Cuadro 4). De los primeros se aislaron 8 cepas y de los segundos
42, resultando porcentajes de aislamiento significativamente
diferentes: 4.7% y 17.8% (p<0.001). La sensibilidad del
método de
aislamiento se determinó en personas con dengue confirmado
por serología y ésta fue de 26.7% (42/157). El
virus se aisló con mayor frecuencia de sueros agudos sin
anticuerpos IgM (31.3%; 27/86) que cuando estos estuvieron
presentes (21.1%; 15/71) aunque las diferencias no fueron
significativas (p=0.147). Se encontraron los 4 serotipos
distribuidos temporalmente. El DEN-1 y el DEN-2 se aislaron en
los 3 años del estudio (2 y 6 cepas, respectivamente),
mientras que el DEN-4 se aisló sólo en el
año 2000 (2 cepas) y el DEN-3 entre los años 2003 y
2004 (40 cepas).

DISCUSIÓN
Existen por lo menos dos razones para la vigilancia del
dengue basada en el laboratorio. La primera porque se requiere
confirmar los casos teniendo en cuenta que existen enfermedades
clínicamente semejantes (sarampión, influenza,
leptospirosis, fiebre tifoidea, malaria, otras) e igualmente
frecuentes. La segunda porque se ha demostrado que el riesgo de
epidemias de dengue e incremento de casos hemorrágicos
puede depender del serotipo y la cepa del virus que este
circulando19,20.
En la mayoría de las localidades donde ocurre el
dengue la vigilancia de casos se realiza por serología
para IgM empleando ELISA de captura (MAC-ELISA). En este estudio
se usaron dos protocolos para
estudiar pacientes sospechosos durante períodos no
epidémicos. En 49.3% y 73.8% se detectó la IgM por
el MAC-ELISA o el UM-ELISA, respectivamente. Esta frecuencia fue
mayor que la observada durante epidemias en otras áreas
endémicas. Por ejemplo, en la de Cuba en 1997 sólo
17.2% de los casos informados al sistema de vigilancia fueron de
dengue21; en la de Belén, Brasil, entre
1996 y 1997, 21.2%22;y en la de Nicaragua en 1998,
43%23. Esas diferencias son posibles teniendo en
cuenta que normalmente se informan individuos con otras virosis
semejantes al dengue, con mayor frecuencia durante brotes, dada
la alarma médica que este produce. Sin embargo, cuando el
porcentaje de casos IgM+ se compara con el encontrado en otros
estudios de búsqueda activa de casos, el del MAC-ELISA fue
más cercano que el del UM-ELISA. Esto es, 49.3% y 73.8%
vs. 37%24, 31.7%11 ó
35%25.
Por el diseño
del estudio no se pudo concluir si la mayor frecuencia de casos
IgM+ por el UMELISA se debió a mayor sensibilidad de la
prueba. No obstante, la discordancia de resultados con el
MAC-ELISA sugiere mayor sensibilidad pero menor especificidad,
considerando la concordancia de los resultados de la segunda con
la de los otros estuches; además, porque por el MAC-ELISA
local se procesaron sueros previamente analizados en el IPK
(Cuba) y los resultados fueron 100% concordantes (Dra. Guadalupe
Guzmán, comunicación personal). Otros
hallazgos que respaldan la hipótesis de baja especificidad del UMELISA
son los siguientes: a) el porcentaje de casos IgM+ en el suero
agudo de casos sospechosos (61.1%) fue superior al de pacientes
con dengue confirmado por aislamiento del virus (38.9% hasta
58%)11,24,26,27. Por tanto, un porcentaje como el
obtenido con el UMELISA no se esperaba porque normalmente se
remiten al SIVIGILA casos que no son de dengue. b) la frecuencia
de casos IgM+según resultados del UMELISA fue similar en
años diferentes a los del estudio, tanto en el suero agudo
como en el convaleciente.
Los autores descartan algún sesgo en la selección
de los sueros que resultara en la mayor positividad del UMELISA,
como inclusión de pacientes con mayor probabilidad de
sufrir dengue, porque la selección se hizo al azar y los
datos se conocieron meses más tarde. Sin embargo, no se
puede descartar inexactitud del dato del día de colecta.
Esto es, sueros considerados agudos podrían ser del sexto
día o más considerando que esta información
fue suministrada por el paciente y por lo mismo subjetiva. Un
factor que pudiera haber contribuido a la alta positividad del
UMELISA es el punto de corte. Cuando se incrementó de 0.3
a 0.8 DO el número de casos IgM+ fue similar a los del
MAC-ELISA local. No es conocido por los autores que se hubiesen
procesado sueros de individuos sanos residentes en la
región para establecer el punto de corte del
UMELISA.
La vigilancia virológica es útil para
predecir la magnitud y severidad de un brote porque incrementos
en la tasa de aislamientos virales, que reflejan emergencia o
introducción de un serotipo, se pueden
descubrir tempranamente28. Es conocido que el éxito
del aislamiento es mayor cuando los sueros se procesan en las
primeras horas de la colecta, porque el almacenamiento
prolongado a temperaturas inadecuadas disminuye la viabilidad del
virus9,31,32. En este estudio se aislaron más
cepas de sueros almacenados a -70oC (17.8%), que a
4oC, (4.7%). En el Laboratorio de Arbovirus del
CINTROP se encontró que el almacenamiento a 4oC
por 8 días de sueros contaminados experimentalmente con
DEN-4, disminuye hasta 1,000 veces el número de UFP/ml que
se recuperan en el cultivo (datos no mostrados). Por tanto, es
prioritario para la vigilancia virológica instruir al
personal encargado de la recolección de los sueros sobre
la importancia de remitirlos al laboratorio en el menor tiempo
posible, o en su defecto almacenarlos por tiempo y a temperatura
adecuados; así se podrá aislar con más
frecuencia serotipos de baja circulación y descubrir la
entrada de un nuevo virus con antelación al
brote.
El éxito en el control del
dengue depende de cuánto, a través de la
vigilancia, se puede predecir el inicio de una epidemia, lo que a
su vez depende de la rapidez, calidad e
interpretación apropiadas de las pruebas de
laboratorio. Cuando la vigilancia se realiza con un único
suero el estimativo del número de casos es impreciso como
se confirmó en este estudio. Se puede incluir casos como
dengue que en realidad no lo sufrieron o excluir los que si
tuvieron (IgM- en suero agudo). Por las dificultades
logísticas inherentes al sistema de salud colombiano y al
de la misma cultura, es
difícil establecer una vigilancia activa para
recolección de sueros pareados. Como consecuencia la
muestra recomendada sería el suero colectado
después del sexto día porque se aumenta la
probabilidad de confirmar los casos. Sin embargo, esto tiene los
siguientes inconvenientes:
1. La mayoría de pacientes reciben asistencia
médica durante la etapa aguda y son pocos con quienes se
tiene contacto después de ésta. En la experiencia
de los autores, en 2% de los que se siguieron no se
consiguió la aceptación para la segunda muestra y
de 25 que se citaron telefónicamente ninguno
acudió.
2. La posibilidad de conocer los virus circulantes
disminuye significativamente porque el aislamiento es exitoso del
suero de los primeros 4 días de
síntomas.
3. Infecciones recientemente pasadas se podrían
informar como agudas (2.8% en este estudio), considerando que la
IgM se puede detectar hasta por 3 meses. Vaughn et
al.24 encontraron 2% de infecciones recientes en
niños
tailandeses con síndrome febril compatible con
dengue.
Los resultados aquí presentados muestran que para
una adecuada vigilancia del dengue, en localidades donde es poco
factible el seguimiento del paciente, es una prioridad utilizar
pruebas que permitan confirmar el caso e identificar el virus
simultáneamente en el suero colectado durante la primera
consulta. La RT-PCR32-34 y la detección de
antígeno por el ELISA35, constituyen
alternativas, pero deberán evaluarse a nivel local para
determinar su utilidad en
términos de sensibilidad y costo-beneficio.
Mientras estas se establecen y dadas las dificultades para la
recolección de sueros pareados, los autores hacen las
siguientes recomendaciones para una mejor vigilancia del dengue
basada en el laboratorio:
1. Colectar muestras pareadas en todos los casos que sea
posible, remitiendo al laboratorio el suero agudo en las primeras
horas.
2. Cuando sólo es posible recolectar un
único suero, hacerlo con preferencia en la convalecencia y
almacenarlo a -20oC antes de ser remitido al
laboratorio.
3. En pacientes hospitalizados recolectar el suero el
día de la primera consulta y si el paciente es dado de
alta antes del sexto día de síntomas, citarlo al
laboratorio para la toma de la segunda muestra.
Siguiendo estas recomendaciones será posible una
mayor precisión de los datos y de la magnitud del problema
del dengue, además de identificar tempranamente los
factores de riesgo y mantener un sistema de alerta inmediata en
prevención de epidemias.
AGRADECIMIENTOS
Los autores agradecen a la Secretaría de Salud
del Departamento de Santander por permitir la información
del UMELISA. Al Dr. Vancen Vorndam del CDC, Puerto Rico, por el
suministro de anticuerpos y antígenos y al Instituto Pedro
Kourí, Cuba, por el estuche del MAC-ELISA. A Sergio
Yebrail Gómez por el apoyo técnico.
REFERENCIAS
1. Gubler JD, Clark CG. Dengue/dengue hemorrhagic fever:
the emergence of a global health problem. Emerg Infect Dis 1995;
1: 55-57.
2. Rothman AL. Viral pathogenesis of dengue infections.
In: Gubler DJ, Kuno G (eds.). Dengue and dengue hemorragic fever.
London: CAB International; 1997. p. 245-272.
3. Pancharoen C, Kulwichit W, Tantawichien T, Thysiakorn
U, Thisyakorn C. Dengue infection: a global concern. J Med Assoc
Thai 2002; 85 (Suppl 1): 25-33.
4. Guzmán MG, Kouri G. Dengue and dengue
hemorrhagic in the Americas: lessons and challenges. J Clin Virol
2003; 27: 1-3.
5. Ministerio de Salud. Prevención y control del
dengue. Informe ejecutivo, Sistema Nacional de Vigilancia
(SIVIGILA). Bogotá: Ministerio de Salud; 2001.
6. Ministerio de Salud. Prevención y control del
dengue. Informe ejecutivo, Sistema Nacional de Vigilancia
(SIVIGILA). Bogotá: Ministerio de Salud; 2002.
7. Rey JJ, Segura AM. La estratificación
epidemiológica del riesgo. Una estrategia alternativa en
el control del dengue para el área metropolitana de
Bucaramanga, Bol Epidemiol; 2003: 8-25.
8. World Health Organization. Dengue haemorrhagic fever:
diagnosis, treatment, prevention and control. 2nd ed. Geneva:
World Health Organization; 1997. p. 12-47.
9. Vorndam V, Kuno G. Laboratory diagnosis of dengue
virus infections. In: Gubler DJ, Kuno G (eds.). Dengue and dengue
hemorragic fever. London: CAB International; 1997. p.
313-333.
10. Ruechusatawat K, Morita K, Tanaka M. Daily
observation of antibodies levels among dengue patients detected
by enzyme-linked immunosorbent assay (ELISA). Jpn Trop Med Hyg
1994; 22: 9-12.
11. Green S, Vaughn DW, Kalayanarooj S, et al. Dengue in
early phase: viremia and antibody responses. J Infec Dis 1977;
176: 322-330.
12. Kouri GP, Guzmán MG, Bravo JR, Triana C.
Dengue haemorrhagic fever/dengue shock syndrome: lessons from the
Cuban epidemic, 1981. Bull WHO 1989; 67: 375-380.
13. Guzmán MG, Kouri G, Morier L, Soler M,
Fernández A. A study of fatal hemorrhagic dengue cases in
Cuba, 1981. PAHO Bull 1984; 18: 213-220.
14. Guzmán MG, Vázquez S, Martines E, et
al. Dengue in Nicaragua, 1994: reintroduction of serotype 3 in
the Americas. Bol Oficina Sanit
Panam 1996; 121: 102-110.
15. Gubler DJ, Kuno G, Sather GE, et al. Mosquito cell
cultures and specific monoclonal antibodies in surveillance for
dengue viruses. Am J Trop Med Hyg 1984; 33: 158-165.
16. Gobernación de Santander, Secretaría
de Salud Departamental, Subdirección de Salud
Pública. Plan de
contingencia Fiebre Amarilla Santander, enero 2004. URL
disponible en
17. Rodríguez R, Álvarez M, Guzmán
M, Morier L, Kouri G. Comparision of rapid centrifugation assay
with conventional tissue culture method for isolation of dengue 2
virus in C6/36-HT cells. J Clin Microbiol 2000; 38:
3508-3510.
18. Burke D, Nisalak A, Ussery M. Antibody capture
immunoassay detection of Japanese encephalitis virus
immunoglobulin M and G antibodies in cerebrospinal fluid. J Clin
Microbiol 1982; 15: 1034-1042.
19. Gubler DJ, Reed D, Rosen L, Hitchcock J.
Epidemiologic, clinical, and virologic observations on dengue in
the Kingdom of Tonga. Am J Trop Med Hyg 1978; 27:
581-589.
20. Gubler DJ, Suharyono W, Lubis I, Eram S, Gunarso S.
Epidemic dengue 3 in Central Java, associated
with low viremia in man. Am J Trop Med Hyg 1981; 30:
1094-1099.
21. Kouri G, Guzmán MG, Valdés L, et al.
Reemergence of dengue in Cuba: A 1997 epidemic in Santiago de
Cuba. Emerg Infect Dis 1998; 4: 89-92.
22. Travassos da RA, Vasconcelos P, Travassos da RE, et
al. Dengue epidemic in Belem, Pará, Brazil, 1996-1997.
Emerg Infect Dis 2000; 6: 298-301.
23. Harris E, Videa E, Pérez L, et al. Clinical,
epidemiological and virological features of dengue in the 1998
epidemic in Nicaragua. Am J Trop Med Hyg 2000; 63:
5-11.
24. Vaughn DW, Green S, Kalajanarooj S, et al. Dengue
viremia titer, antibody response pattern and virus serotype
correlate with disease severity. J Infect Dis 2000; 81:
2-9.
25. Kalayanarooj S, Vaughn DW, Nimmannitya S, et al.
Early clinical and laboratory indicators of acute dengue illness.
J Infect Dis 1997; 176: 313-321.
26. Innis BL, Nisalak A, Nimmannitya S, et al. An
enzyme-linked immunosorbent assay to characterize dengue
infections where dengue and japanese encephalitis co-circulate.
Am J Trop Med Hyg 1989; 40: 418-427.
27. Nogueira RM, Miagostovich MP, Cavalcanti SM,
Marzochi KB, Shatzmayr HG. Levels of IgM antibodies against
dengue virus in Rio de Janeiro. Res Virol 1992; 143:
423-427.
28. Rigau JC, Gubler DJ. Surveillance for dengue and
dengue hemorrhagic fever. In: Gubler DJ, Kuno G (eds.). Dengue
and dengue hemorragic fever. London: CAB International; 1997. p.
405-423.
29. Rigau JC, Ayala A, García E, et al. The
reappearance of dengue-3 and a subsequent dengue-4 and dengue-1
epidemic in Puerto Rico. Am J Trop Med Hyg 2002; 67:
355-362.
30. Fakeeh M, Zaki M. Virological and serological
surveillance for dengue fever in Jeddah, Saudi Arabia, 1994-1999.
Am J Trop Med Hyg 2001; 65: 764-767.
31. Yamada KI, Takasaki T, Nawa M, Kurane I. Virus
isolation as one of the diagnostic method por dengue virus
infection. J Clin Virol 2002; 24: 203-209.
32. Vaughan HE, George A, Morris-Glasgow V,
Campione-Piccardo J. Molecular diagnosis of dengue by reverse
transcriptase-polymerase chain reaction. West Indian Med J 1999;
48: 118-122.
33. Yamada K, Nawa M, Takasaki T, Yabe S, Kurane I.
Laboratory diagnosis of dengue virus infection by reverse
transcriptase polymerase chain reaction (RT-PCR) and IgM-capture
enzyme -linked immunosorbent assay (ELISA). Jpn J Infect Dis
1999; 4: 150-155.
34. Balmaseda A, Sandoval E, Pérez L,
Gutiérrez CM, Harris E. Application of molecular typing
techniques in the 1998 dengue epidemic in Nicaragua. Am J Trop
Med Hyg 1999: 6; 893-897.
35. Young PR, Hilditch PA, Bletchly C, Halloran W. An
antigen capture enzyme-linked immunosorbent assay reveals high
levels of the dengue virus protein NS1 in the sera of the
infected patients. J Clin Microbiol 2000; 38:
1053-1057.
Raquel E. Ocazionez, Ph.D.2, Fabián
Cortés, Bact.3, Luis Angel Villar,
M.Sc.4
1. Este trabajo fue
financiado por COLCIENCIAS (Proyecto Nº
11020413042) con el apoyo de la Secretaría de Salud del
Departamento de Santander (Contrato Nº
133-99).
2. Profesora Asociada, Departamento de Ciencias
Básicas, Escuela de
Medicina,
Directora Laboratorio de Arbovirus, Centro de Investigaciones en
Enfermedades Tropicales (CINTROP), Laboratorio de
Virología, Universidad Industrial de Santander,
Bucaramanga.
3. Bacteriólogo, Centro de Investigaciones en Enfermedades
Tropicales (CINTROP), Universidad Industrial de Santander,
Bucaramanga.
4. Profesor
Asociado, Departamento de Ciencias Básicas, Escuela de
Medicina. Investigador Asociado, Centro de Investigaciones
Epidemiológicas (CIE),Universidad Industrial de Santander,
Bucaramanga.
 Página anterior Página anterior |   Volver al principio del trabajo Volver al principio del trabajo | Página siguiente  |
