Informe de un
experimento
Se lleva a cabo este experimento para una
reacción de neutralización y ver cómo
actúa un indicador, utilizando la fenolftaleína. A
la vez nos servirá cuando queremos saber las propiedades
de la disolución cuando no tenemos conocimiento de su
naturaleza como saber si es ácida o
básica.
Sustancias:
Solución de Bicarbonato de Sodio
Hidróxido de Calcio
Hidróxido de Potasio
Indicador ácido-base:
fenolftaleína
Para medición o
recipientes:
Matraz Erlenmeyer de 250 mL
Botella de vidrio de boca angosta
Popote
1 cuchara pequeña
Gotero

Hay que realizar una hipótesis a cerca de lo
que se espera obtener durante esta práctica
científica para hacer esta reacción
neutra.Colocar en el matraz Erlenmeyer o en la botella de
vidrio una cucharadita de bicarbonato de sodio.Poner aproximadamente unos 30 mL de la
solución que tenga el bicarbonato de sodio en el
contenedor utilizado por la cucharadita del bicarbonato de
sodio.Agregar unas 2 o 3 gotas del indicador de acido-base
(fenolftaleína).Introducir el popote. Salir del lugar donde se
está realizando el experimento, junto con el
recipiente con la mezcla y recorrer el exterior durante poco
tiempo.Al regresar, sopla dentro del frasco que utilizaste
con la solución con ayuda del popote. Recuerda
únicamente soplar, más no absorberSeguir soplando hasta ver que el color de la
solución esté cambiando.Después de esto hay que comparar la
hipótesis anteriormente planteada con los resultados
obtenidos, así podremos saber las conclusiones un poco
mas aclaradas, con un pequeño nivel de dudas, ya que
seguimos paso a paso este experimento.
Antes que nada es importante saber las principales
propiedades de las sustancias ácidas y las bases, para
poder entender mejor este experimento y sobre todo del tema que
trata que entendamos representativamente la
neutralización; a continuación se muestra algunas
de sus propiedades:

Sabemos que cuando una sustancia diluida en una cantidad
determinada de fenolftaleína tomará un color,
según el nivel de acidez, alcalinidad o
neutralización en el que está; esto se puede
determinar gracias al experimento que anteriormente se
practicó, así lo podemos comprobar en base a algo
experimental.
Cuando en una solución acuosa (con H2O) se
mezclan un determinadas cantidades equivalentes de una sustancia
ácida con una alcalina, da lugar a una disolución
neutra, a este método se le conoce como
neutralización.
Aquí lo que es el principal objetivo es de poder
identificar entre sustancias caseras, si es ácida, si es
básica o si es neutra. Mediante esto sabremos si
está no está aun en forma ionizada, utilizando un
indicador ácido-base para partir de ese punto de
estabilidad: si se hace ácida, o básica, o se queda
como es, neutra.
El utilizar el indicador fenolftaleína para la
Química es muy grande su uso, y no solamente por el
hermoso color que toma cuando reacciona como base o ácido
al mezclarse con una sustancia, sino que también permite
hacer mediciones exactas, reales y fáciles para comprobar
la neutralización, los niveles de acides o alcalinidad en
estas sustancias. Esto se descubrió en 1905, gracias a un
científico llamado Von Baeyer junto su química,
atraído a los colores de las reacciones de sus
experimentos.
Es por eso que cuando se mezclan estas sustancias, es
decir en este caso el Bicarbonato de sodio +
fenolftaleína obtenemos un color violeta o
"magenta" lo cual significa que es un sustancia base la cual
está ligeramente en un nivel de alcalinidad, pero si se
mezclara con otro tipo de sustancia como cítrico,
generalmente tiene niveles altos en ácidos, no tiene
color, o sea es incoloro esto indica que ha pasado a ser
una sustancia ácida.
El pH es un factor muy importante, porque
determinados procesos químicos solamente pueden tener
lugar a un determinado pH. El pH es un indicador de la acidez de
una sustancia. Está determinado por el número de
iones libres de hidrógeno (H+) en una sustancia.El termino
pH proviene del abreviar "pondus Hydrogenium". Esto
significa literalmente el peso del hidrógeno. El pH es un
indicador del número de iones de hidrógeno.
Tomó forma cuando se descubrió que el agua estaba
formada por protones (H+) e iones hidroxilo (OH-).
Hay muchos y diversos métodos en los cuales los
utilizamos para medir el pH. Uno diferente utilizado
anteriormente es usando un trozo de papel indicador del
pH.
Cuando se introduce el papel en una solución,
cambiará de color. Cada color diferente indica un valor de
pH diferente. Este método no es muy preciso y no es
apropiado para determinar valores de pH exactos. Es por eso que
ahora hay tiras de test disponibles, que son capaces de
determinar valores más pequeños de pH, tales como
3.5 o 8.5.
El método más preciso para determinar el
pH es midiendo un cambio de color en un experimento
químico de laboratorio. Con este método se pueden
determinar valores de pH, tales como 5.07 y 2.03.
Cuando los ácidos entran en contacto
con el agua, los iones se separan. Por ejemplo, el cloruro de
hidrógeno se disociará en iones hidrógeno y
cloro (HCL–à H+ + CL-).Las bases también se
disocian en sus iones cuando entran en contacto con el agua.
Cuando el hidróxido de sodio entra en el agua se
separará en iones de sodio e hidroxilo (NaOH–à Na+
+ OH-).
Cuando una sustancia ácida acaba en
el agua, le cederá a ésta un protón. El agua
se volverá entonces ácida. El número de
protones que el agua recibirá determina el pH. Cuando una
sustancia básica entra en contacto con el agua
captará protones. Esto bajará el p del agua.Cuando
una sustancia es fuertemente ácida cederá
más protones al agua. Las bases fuertes cederán
más iones hidroxilo.
Durante el proceso que los seres humanos
que realizamos y lo llamamos "alimentación"
nosotros necesitamos un nivel ácido, para poder
descomponer fácilmente los alimentos, mas no demasiado ya
que si se encuentra muy ácido puede causar lesiones
internas que provocarían ulceras, gastritis o enfermedades
gástricas de este tipo. Para combatir estos padecimientos
es necesario consultar primeramente a un médico y este
sabrá que recetar dependiendo del nivel de
acidez.
El estómago produce acido
clorhídrico para digerir los alimentos, sin embargo esta
sustancia puede ser excesiva si se consumen alimentos irritantes
o muy condimentados, y regularmente para combatir la acidez en el
estómagos tomamos los analgésicos o salde uvas y
una base para contrarrestarlo es el bicarbonato con
agua.
Cuando sentimos un pequeño ardor,
agruras o acidez, es necesario tomar un antiácido la cual
contiene una base (media alcalina) que permite actuar en contra
de la acidez en el estómago.
El antiácido actúa en forma
neutralizadora la cual aumenta los niveles de alcalinidad en el
pH de mucosa estomacal. Los antiácidos más antiguos
y conocidos (comúnmente son caseros) son el carbonato
cálcico (CaCO3) y el bicarbonato sódico (NaHCO3).
Otro tipo de antiácidos lo son los inhibidores de la bomba
de protones y las sustancias citoprotectoras.
En otras palabras los antiácidos son
bases débiles por lo que solamente actúan por
reacción de la neutralización para el ácido
estomacal y, formar la sustancia de agua con sal.
El genérico usado comúnmente
en los antiácidos estomacales comerciales es:
HCl (ácido gástrico) +
Antiácido (base débil) ? H2O +
CO2 + sales
Para neutralizar una de las fórmulas
más conocidas para los antiácidos es el
hidróxido de aluminio, la cual su ecuación
química puede ser:
3 HCl + Al (OH)3 ?
AlCl3 + 3 H2O
Y la reacción del bicarbonato de
sodio está relacionada con la liberación de CO2 que
salen a través de un simple y pequeño
eructo.[
Otro ejemplo para comprender el tema de
neutralización y además aprender cómo se
forman las sustancias acidas a alcalinas (bases) o viceversa, es
la lluvia acida que se debe a la sustancia
producida ácido carbónico no es
suficientemente ácida como para producir el color
rojo.
La causa de la aparición del color rojo
está en el dióxido de azufre (SO2)
que se forma cuando la cerilla se inflama. Esto se debe a la
presencia de azufre (S) añadido, entre otros
productos, a la cabeza de la cerilla, para favorecer la
ignición.
El dióxido de azufre en contacto con
el agua presente en la tira de papel forma ácido sulfuroso
(H2SO3) que es más ácido que el ácido
carbónico. En la combustión de algunos
derivados del petróleo se produce dióxido de azufre
que pasa a la atmósfera. Al llover y entrar en contacto
con el agua, se forma el ácido sulfuroso uno de los
responsables de la lluvia ácida.
Enseguida se te presenta una lista de
productos y su pH:
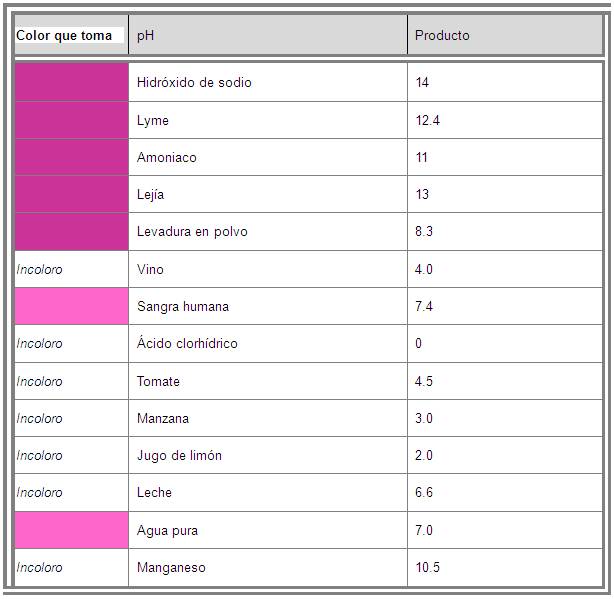
Es el color ![]() aproximado que toman estas sustancias cuando se les agrega
aproximado que toman estas sustancias cuando se les agrega
la fenolftaleína.
Esto queda resumido en que, al soplar expulsamos
dióxido de carbono (CO2) que en contacto con el agua forma
ácido carbónico (H2CO3). Este ácido formado,
neutraliza el amoníaco que contiene la disolución.
Al añadir vinagre la solución adquiere un pH
ácido.
Se pudo observar el volumen en el cual el número
de moles de H3O+ era igual al número de moles de OH- . Se
concluye que una de las formas más simples y
fáciles de comprender una reacción de
neutralización es a través del uso.
Referencias
LANDA, Gregorio. "Materia 3: Ciencias III con
énfasis en Química". Fernández Editores.
México, 2011.MILLER, Glenn; AUGUSTINE, Frederick. "Química
elemental". Harla. Estados Unidos, 1978.BURNS, Ralph: "Fundamentos de Química",
2ª edición. Argentina. Editorial Pentice –
Hall Hispanoamericanahttp://es.wikipedia.org/wiki/Fenolftale%C3%ADna#Qu.C3.ADmica
http://es.wikipedia.org/wiki/Neutralizaci%C3%B3n
http://eltamiz.com/2010/07/14/premios-nobel-quimica-1905-adolf-von-baeyer/
http://www.monografias.com/trabajos76/acidos-carboxilicos-quimica/acidos-carboxilicos-quimica
http://es.wikipedia.org/wiki/Adolf_von_Baeyer
http://fq-experimentos.blogspot.com/2008/08/neutralizacin-cido-base.html
http://www.7735.com/es/sale/hidr%C3%B3xido-de-calcio-cal-hidratada-cc8711
http://html.rincondelvago.com/acidos-y-bases_8.html
http://es.wikipedia.org/wiki/Bicarbonato_de_sodio
http://www.lenntech.es/ph-y-alcalinidad.htm
http://es.answers.yahoo.com/question/index?qid=20070408204708AAU04up
http://www.edu.aytolacoruna.es/aprende_y_juega/aula_virtual
http://www.quimicaweb.net/enlaces/enlaces.htm#fisica
http://www.iestiemposmodernos.com/diverciencia/
http://www.iestiemposmodernos.com/diverciencia/la_qc/qc_marco.htm
http://www.fisicayquimica.com/
http://ciencianet.com/acidobase.html
http://www.monografias.com/trabajos71/reacciones-acido-base/reacciones-acido-base2
http://es.wikipedia.org/wiki/Anti%C3%A1cido
Autor:
Fiama Nayeli García Mata
