Una recopilación de las
reacciones de oxidación y reducción de mayor
importancia en la síntesis orgánica

El manejo de la reactividad de las moléculas
orgánicas desde la perspectiva de los procesos de
oxidación y reducción en síntesis
orgánica, requiere del químico orgánico un
dominio adecuado de los mismos, para encarar reacciones
quimioselectivas o estereoespecíficas, que permitan
desarrollar las reacciones requeridas, con los mayores
rendimientos y la menor cantidad de formación de
subproductos no requeridos.
En tal virtud, es muy necesario contar con una obra, que
contenga las reacciones de oxidación y reducción
debidamente probadas, que permitan aproximarse a los
requerimientos de pureza y selectividad previstos en cada una de
las etapas de una síntesis orgánica.
Las revistas científicas del área de
química orgánica o más propiamente de
síntesis orgánica, proporcionan una cantidad
importante de estudios efectuados sobre el comportamiento de los
agentes reductores y oxidantes, para una gama amplia de
sustratos, de manera que lo que ayer se afirmaba, sobre la
imposibilidad de transformar cierto grupo en presencia de otro,
hoy es cada vez menos cierta.
En los últimos tiempos, muchas reacciones de
oxidación y reducción se encaran a través
del uso de catalizadores diversos, que pasan por la estructura de
complejos tradicionales de metales como el Rh, Ir o Ru,
así como la cada vez mayor incorporación de
polímeros como soportes activos para disponer de
hidrógenos en cantidades suficientes para lograr las
transformaciones selectivas de muchos grupos
funcionales.
Asimismo, es permanente el propósito de conseguir
reactivos más amigables con el medio ambiente para ir
sustituyendo aquellos oxidante y/o reductores tóxicos como
los del Sn, Hg, etc por ejemplo, hoy sustituidos por una enorme
variedad de silanos.
La bibliografía al respecto es bastante abundante
y sólo el criterio profesional del químico
orgánico sobre la viabilidad de los mismos, en base a
posibilidades ciertas de disponibilidad de los mismos en un
laboratorio de química apoyará la decisión
de usar uno o varios de ellos, tanto en los diseños de
síntesis como en la misma ejecución
experimental.
En todo caso, se pone a disposición de
estudiantes y profesionales químicos, la presente obra,
que recopila una importante cantidad de reacciones de
oxidación – reducción, para que la misma
sirva de consulta y oriente los emprendimientos en
síntesis orgánica.
Potosí, diciembre de 2011
"El valor, es el comienzo de la acción,
pero la casualidad es la dueña del final ".
Demócrito.
En general los conceptos precisos que se tienen de
oxidación y reducción en la química
inorgánica, son igualmente válidos en
química orgánica, no obstante, los mismos no pueden
trasladarse mecánicamente al campo de la química
orgánica, debido a la naturaleza covalente y/o polar de
los enlaces predominantes en esta última.
Sin embargo, se han desarrollado conceptos alternativos
y/o complementarios adecuados a la química orgánica
sobre la oxidación y la reducción, los cuales
pueden resumirse en los siguientes términos:
Las reacciones que originan nuevos enlaces,
generalmente con el hidrógeno o los metales, deben de
entenderse y tomarse como reducciones.La abstracción de hidrógeno de una
molécula, para formar enlaces múltiples
ó para producir nuevos enlaces entre el carbono y
elementos más electronegativos que éste, tales
como halógenos, oxígeno, nitrógeno y
azufre, se toman como oxidaciones
Por otro lado, todas las reacciones de oxidación
y reducción, debe sobreentenderse que se hallan
comprendidas dentro de los grupos de reacción grandes,
tales como: Adición, Sustitución,
Eliminación, etc.
En general se puede afirmar que todos los agentes
oxidantes aplicados en la química inorgánica, son
también útiles en química orgánica,
bajo condiciones adecuadas de control, para evitar la
destrucción de la molécula. Los sistemas de
oxidación más comunes, comprenden las siguientes
alternativas:
Pirólisis catalítica
Reactivos basado en un metal: Reactivos de cromo,
manganeso, estaño, Hierro, Rutenio y otros
metales.Reactivos basados en no metales: Dimetil
sulfóxido (DMSO) activado, peróxidos y
perácidos, oxígeno/ozono y otros.Epoxidaciones
1.1. Formación de enlaces múltiples
C-C.
Las reacciones de deshidrogenación se llevan a
cabo haciendo pasar vapor del sustrato, que normalmente son
alcanos, cicloalcanos, alquenos y ciclooalquenos, sobre el lecho
caliente de un catalizador sólido específicamente
preparado.

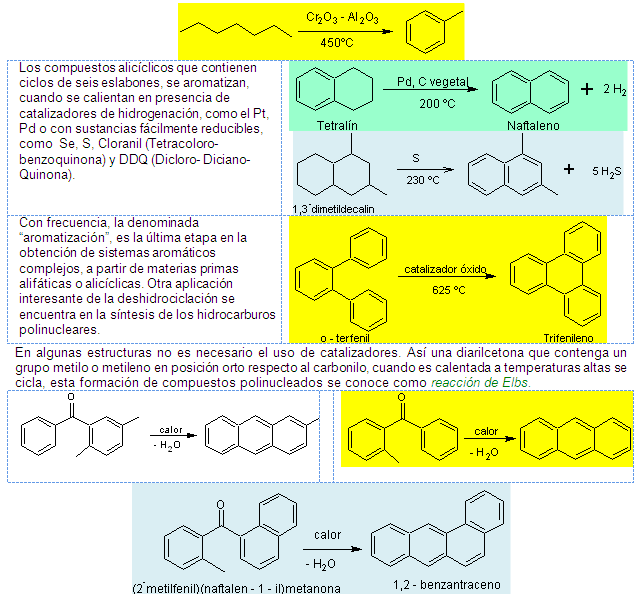
Los alcanos que contienen cadenas de seis o más
átomos de carbono, sufren deshidrociclación, que
los convierte en aromáticos. Un ejemplo es la
producción comercial del tolueno.
1.2. Formación de enlaces C –
O
Los compuestos orgánicos que contienen enlaces C
– O, forman una serie continua con respecto al nivel de
oxidación, como puede verse a
continuación:

Oxidación de Hidrocarburos
Una oxidación completa de un compuesto
orgánico, que sólo contiene C e H, es
sinónimo de la combustión de dicho compuesto, y
esto produce en todos los casos CO2 y H2O. La oxidación de
los hidrocarburos en aire a bajas temperaturas, son
difíciles de controlar, debido a que las mismas son
reacciones de radicales libres, estas oxidaciones son selectivas
en las posiciones adyacentes a los dobles enlaces. Algunos
ejemplos útiles son los siguientes:

Por otro lado, la facilidad de oxidación de los
anillos aromáticos varía considerablemente, en el
caso de los arenos que contienen grupos alquílicos, los
mismos son fáciles de ser oxidados a ácidos
carboxílicos y si los grupos alquilo son ramificados,
unidos al anillo bencénico, como el caso del cumeno, la
oxidación con el oxígeno del aire forma fenoles y
como subproducto acetona (Es muy frecuente el error de proponer
como producto de oxidación del cumeno al ácido
benzoico, lo cual es totalmente incorrecto). En el caso del
t-butilbenceno, sencillamente no ocurre la oxidación del
alquilo.

La facilidad de oxidación de los anillos
aromáticos varía considerablemente, así, en
condiciones drásticas el benceno se oxida a
anhídrido maleico, mientras que uno de los anillos del
naftaleno lo hace mucho más rápidamente y el
antraceno se oxida con mucha facilidad a 9,10 –
antraquinona.

Las cadenas laterales alquílicas en el benceno,
pueden ser oxidadas por algunos reactivos específicos sin
causar gran degradación del esqueleto
carbonado.

Un ejemplo de este tipo de reacciones lo constituye la
reacción de Etard, en la que un grupo
metilo se oxida a aldehído con cloruro de
cromilo.
El método más conveniente para la
introducción de un grupo hidroxilo alcohólico en
posición alfa en un núcleo aromático es el
que utiliza la bromación de la cadena lateral seguido de
hidrólisis básica.

La N–bromosuccinimida (NBS), puede generar
desplazamientos de los dobles enlaces, generando preferentemente
estructuras alílicas

Oxidación del enlace
olefínico
Las reacciones de oxidación de dobles enlaces
presentan importancia en síntesis y en reacciones de
degradación. Las siguientes son las reacciones de mayor
significación:
Hidroxilación. La hidroxilación
olefínica, para formar un alcohol, presenta las
siguientes alternativas:
Adición de H2SO4 e hidrólisis.
Este método es uno de más clásicos, el
ácido sulfúrico, no debe ser concentrado y
tampoco muy diluído.

Oximercuración–Desmercuración.
Los alquenos reaccionan con acetato mercúrico en una
mezcla de tetrahidrofurano (THF) y agua, para producir
compuestos hidroxialquilmercúricos.
Estos compuestos pueden reducirse a alcoholes
tratándolos con borohidruro de sodio (NaBH4).

La oximercuración – desmercuración es
altamente regioespecífica. La orientación neta de
la adición del –OH del agua, se realiza de acuerdo
con la regla de Markovnikov.

Si los alcoholes que se utilizan como sustratos son
terciarios, el acetato de mercurio se sustituye por el
trifluoroacetato mercúrico, Hg(OOCCF3)2.
Hidroboración –
Oxidación. La adición de las especies OH- e
H+ provenientes del agua, a un doble enlace, también
se lleva a cabo en el laboratorio, mediante el uso de hidruro
de boro (BH3)2, llamado comúnmente como
DIBORANO.

Las reacciones de Hidroboración son
regioespecíficas y el resultado neto de la
Hidroboración-oxidación es una aparente
adición anti-Markovnikov del agua al doble enlace,
formando los alcoholes menos sustitutídos.
Hidroboración de Cicloolefinas. La
hidroboración de cicloolefinas con altos rendimientos,
se consigue utilizando el boro hidruro de cinc, Zn(BH4)2,
para formar diversos productos, dependiendo del reactivo que
se haga uso, en la segunda etapa del proceso.
Aldrichimica Acta Vol. 31, Nº 1
1998.

Las aplicaciones sintéticas de esta
reacción resultan ser muy útiles, como puede verse
en los siguientes ejemplos:

Reacción de Prevost: Ag(PhCO2)2I2. Esta
reacción permite acetilar uno de loa átomos de
arbono que forma el doble enlace e hidroxilar el otro
átomo de carbono, con una esterepquímica
cis. Se utiliza I2 como catalizador

Hidroxilación con AlH3/TiCl4/O2. El hidruro
de aluminio se utiliza junto al tetracloruro de titanio y
oxígeno molecular, para hidroxilar las olefinas, en
una reacción similar a la
hidroboración.

Dihidroxilación. La
dihidroxilación de los enlaces olefínicos,
puede generar isómeros cis y
trans–dihidroxilados.
Cis-dihidroxilación.
Los métodos para obtener los isómeros
cis, son los siguientes:
Permanganato de potasio neutro:
KMnO4/H2O
 producto cis
producto cis
Tetróxido de Osmio:
OsO4
El mecanismo de esta reacción
propuesto, muestra la formación de un intermedio
inestable que se transforma en el cis – diol
respectivo:

Uso de óxido de amina terciaria como
catalizador (NMO: N-Metilmorfolina-N-óxido) TL
1976, 1973.

Estereoselectividad de la |
| |
La cis-hidroxilación con
OsO4, es favorecida o se produce preferentemente en los enlaces C
= C, más ricos en electrones

Grupos que dirigen la dihidroxilación.
La presencia de ciertos grupos, como los –OH, -CONHR,
sulfóxidos, nitros y sulfoximinas, en cierto modo
direccionan la posición espacial de los grupos
–OH, que se adicionan al enlace olefínico. En
general estos grupos, hacen que los -OH que se adicionan, lo
hagan en el mismo plano que ellos se encuentran, originando
de este modo un estereoisómero predecible. Chem.
Rev. 1993, 93, 1307.
Efecto de los hidroxilo

Efecto de las amidas

Efecto de las sulfoximinas. Las sulfoximinas, se
sobreponen a un grupo –OH existnte en la estructura y
dirigen a los –OH que se adicionan a un plano distinto
al que se encuentran.

Trans –
Dihidroxilación
Peroxidación e hidrólisis. La
trans – dihidroxilación ocurre en dos etapas,
primero la olefina se oxida con un perácido, para
formar un epóxido que luego es abierto por una simple
hidrólisis ácida

Peroxidación y acidificación con
HCOOH. Ls olefina puede sser epoxidada con peróxido de
hidrogéno, que al ser tratada con ácido
fórmico, genera un compuesto trans –
dihidroxilado.

Oxidación de Wacker. El proceso
industrial de obtención al acetaldehído a
partir de la oxidación de etileno, empleando cloruro
de paladio y cobre como catalizadores y oxígeno
molecular como oxidante, es conocido como la oxidación
de Wacker. La reacción ha sido ampliamente
desarrollada para la oxidación de alquenos terminales
para formar metil-cetonas. J. Smidt et al., Angew. Chem..
Int. Ed.. 1, 176 (1959).

Esta reacción se ha aplicado a los hidroxi
– alfa, beta- insaturado ésteres y otros sustratos
como los alquinos. Cuando la reacción se realiza a escala
de laboratorio, la reacción es conocida como la
oxidación de Wacker-Tsuji:

Una oxidación del tipo Wacker, ocurre cuando se
oxida un alquino interno, para producir 1,2 – dicetonas,
usando oxígeno molecular. W. REn, Y. Xia, S. J, Ji, Y.
Zhang, X. Wan, J. Zhao. Org. Lett., 2009, 11, 1841 –
1844.

Esta reacción también permite una
oxifuncionalización eficiente y conveniente de olefinas
terminales como lo reportan. T. Mitsudome, T. Umetani, N. NOsaka,
K. MOri, T. MIzugaki, K. Ebitani, K. Kaneda. Angew.
Chem. Int. Ed. 2006, 45, 481
-485.

Hidroformilación
(Reacción oxo)
Las olefinas terminales, pueden ser oxidadas, con una
mezcla de gases de CO/H2, sales de de Co(II) como catalizador y
la apliación de presión a una temperatura un poco
mayor a los 110ºC.
![]()
Escisión de enlaces
olefínicos
Oxidación
destructive
| ||||||||||||||||||||||||
Ozonólisis

Ruptura oxidativa de olefinas para
producir cetonas y/o aldehídos

Escisión de dioles (ruptura
del glicol)
Dos reactivos, ácido metaperiódico (o
ácido periódico) y el tetraacetato de plomo rompen
los 1,2 dioles suavemente para formar compuestos de carbonilo.El
mecanismo de estas reacciones, no están del todo
esclarecidos y continúan en discusión. Mientras
unos proponen la formación de ésteres
cíclicos como compuestos intermedios; otros proponen
mecanismos heterolíticos no cíclicos.
Por otro lado estos reactivos se complementan, ya que el
tetraacetato de plomo es soluble en disolventes orgánicos
y el ácido periódico (o metaperiódico) lo es
en agua.

Epoxidación. Los epóxidos son
reactivos intermedios importantes en la síntesis
orgánica, puesto que los mismos pueden ser abiertos
con diversos nucleófilos, tanto en medio ácido
por el lado del carbono con mayor impedimento estérico
y en medio básico, por el carbono que presenta menor
impedimento estérico. Originándose de este modo
una gama amplia de sustratos.
Epoxidación de alquenos. Una
reacción común de formación de
epóxidos, comprende la reacción de un alqueno
con cloro acuoso, seguido por el tratamiento con una base,
otro procedimiento, consiste en poner en equilibrio un
alqueno con el oxígeno del aire, catalizado por plata
metálica.

La adición del oxígeno del
perácido, tiene una geometría anti, por lo cual al
hidrolizarse un epóxido se forman dioles anti.
Epoxidación electrofílica con
Dimetildioxirano (DMDO). El DMDO es un oxidante fuertemente
electrófilo. La oxidación ocurre en condiciones
suaves con sustratos olefínicos ricos en electrones
(nucleófilos). Se utiliza normalmente la acetona.como
disolvente.

Epoxidación nucleofílica. Este tipo de
epoxidación requiere de sustratos olefínicos
conjugados con grupos atractores de electrones, que logran
generar que el carbono beta (ß) al grupo atractor tenga
una carga parcialmente positiva (electrófilo), que
orienta la formación del epóxido.

Epoxidación de alcoholes
alílicos. La epoxidación de Sharpless,
presenta alta regioselectividad en los alcoholes
alílicos y homoalílicos y no epoxida los dobles
enlaces aislados y la epoxidación ocurre
estéreo selectivamente respecto a la cantidad de
alcohol.
El catalizador en la reacción puede ser
cualquiera de los siguientes compuestos: VO(acac)2; Mo(CO)6;
Ti(OiPr)4 y el oxidante puede ser una de los peroxiácidos
siguientes: tBuOOH; PhC(CH3)2OOH. (Comprehensive Organic
Synthesis 1991, vol 7, 389 – 438). También se
puede revisar estas epoxidaciones en: Chem. Rev.
1989, 89, 431. Aldrichimica Acta 1979, 12,
63.

Un estudio comparativo de la acción de los
catalizadores (Synthesis 1986, 89 Org.
React. 1996, 48, 1-299), puede verse en el siguiente
cuadro:

Otra variante de esta reacción se presenta con un
nuevo sistema catalizador para la epoxidación
asimétrica de alcoholes alílicos, la misma se ha
desarrollado con alta enantioselectividad para olefinas Z. La
carga de catalizador es cerca de 1 mol%, las temperaturas de
reacción alrededor de 0 ° C ó a temperatura
ambiente durante un tiempo más corto, se hace uso de una
solución acuosa de terc-butilo hidroperóxido (TBHP)
anhidro como oxidante aquiral. (W. Zhang, A. Basak, Y. Kosugi, Y.
Hoshino, H. Yamamoto, Angew. Chem. Int. Ed.,
2005, 44, 4389-4391).


Tabla No. 01. Resúmen de
reacciones de epoxidación a partir de
olefinas
(Tomado de Burkhard König,
Institut für Organische)
Otras reacciones de epoxidación,
toman en cuenta a los aldehidos y cetonas como sustratos, que
reacción con iluros de azufre, para producir
epóxidos. Igualmente la condensación de Darzens,
forma epóxidos,
Apertura del anillo de
epoxi-alcoholes:

Oxidación alílica con SeO2. Las
olefinas que cuentan al menos con un grupo metileno del tipo
alílico, pueden oxidarse al correspondiente alcohol
alilíco con buenos rendimientos haciendo uso del
SeO2.

El dirhodio (II) caprolactamato, cataliza efectivamente
la oxidación alílica de una variedad de olefinas y
enonas con terc-butilo como oxidante terminal. La reacción
es totalmente selectiva, tolerante al aire y humedad, y se puede
realizar con tan sólo el 0,1% en moles de catalizador en
cuestión de minutos. (A. E. Lurain, A. Maestri, A. R.
Kelli, P. J. Carroll, P. J. Walsh, J. Am. Chem. Soc.,
2004, 126, 13622-13623).

Oxidación de olefinas con tBuOOH y
catalizadores. Utilizando el ligando Quinox y la TBHP
acuosa, se produce una oxidación del tipo Wacker, que
convierte eficientemente sustratos tradicionalmente
difíciles, tales como alcoholes alílicos
protegidos a los productos de oxidación
correspondientes.
Los sustratos que son enantiomeros sufren una
oxidación completa con la retención de
configuración del enantiomero. (B. W. Michel, A. M.
Camelio, C. N. Cornell, M. S. Sigman, J. Am. Chem. Soc.,
2009, 131, 6076-6077).

Oxidación de Alquinos
Hidratación de alquinos. Los alquinos
terminales al ser hidratados, forman inicialmente un enol que
es inestable en el medio de reacción y se tautomeriza
inmediatamente a una cetona o aldehído, como producto
principal.
Ocurre lo anteriormente señalado cuando se
cataliza la hidratación con sales mercúricas en
medio ácido y con el hidroborano Idiborano) en medio de un
oxidante suave y una base, respectivamente.

Reacciones de ruptura de
alquinos

Reacciones de alquinos con peroxidisulfato de
amonio. La oxidación de alquinos con persulfato de
amonio y diseleniuro de difenilo como catalizador en un medio
acuoso conduce a los derivados 1,2-dicarbonílicos o
semiacetales a partir de alquinos terminales. (S. Santoro, B.
Battistelli, B. Gjoka, C.-w. S. Si, L. Testaferri, M. Tiecco,
C. Santi, Synlett, 2010,
1402-1406).
Carbometalación/oxigenación. Los
enoles estereodefinidos, derivados de los
aldehídos, son preparados a partir de alquinos
terminales a través de la acción del
Cp2ZrCl2 catalizado por metilaluminato y la
oxigenación posterior con las especies peroxizinc
electrofílica y anhidridos carboxílicos. El
proceso de carbometalación /oxigenación,
tolera alcoholes libres y heterociclos protegidos,
olefinas y nitrilos. (J. R. DeBergh, K. M. Spivey, J. M.
Ready, J. Am. Chem. Soc., 2008,
130, 7828-7829).

1.3. Oxidación de
Alcoholes1.3.1. Oxidación de alcoholes primarios y
secundarios.1.3.1.1. Oxidación con reactivos de
cromo. La abstracción por oxidación de los
átomos de hidrógeno alfa en los alcoholes
primarios y secundarios, puede realizarse con variados
reactivos de cromo, los cuales dependen del solvente y el pH
del medio de reacción.
En los procedimientos de laboratorio se usa
frecuentemente el ácido crómico, como por
ejemplo en el método de Oppenauer, en el que un exceso
de una cetona barata se equilibra con un alcohol
secundario.Reactivo de Jones

Oxidación de Collins (
CrO3. 2 piridina) TL 1969, 3363

Los alcoholes 1º y 2º son
oxidados a aldehídos y cetonas, respectivamente,
en soluciones no acuosas (CH2Cl2) sin sobre
oxidación.El reactivo de Collins puede ser
preparado y aislado o generado in situ. El aislamiento de
los reactivos a menudo conduce a mejores
rendimientos.Útiles para la
oxidación de compuestos sensibles al H+Debe utilizarse un gran exceso del
reactivoClorocromato de Piridinio (PCC,
Oxidación de Corey – Suggs). TL
1975 2647 Synthesis 1982, 245
(review)

( El reactivo puede ser usado en
cantidades estequiométricas w / sustrato.( El PCC se alimenta ligeramente
ácido, pero puede ser amortiguada w / NaOAc
(Clorocromato de piridin-p-dietilamina: La
reacción es específica para la oxidación
de alcoholes bencílicos, aún existiendo otros
grupos OH en la molécula, los mismo no son atacados si
están presentes –OH
bencílicos.
Dicromato de Piridinio.
(PDC, Oxidación de Corey – Schmidt). TL
1979, 399.

1.3.1.2. Oxidación con reactivos de
ManganesoPermanganato de Potasio, KMNO4/18-Crown-6
(benceno púrpura)

Permanganato de sodio, (NaMnO4)
TL 1981, 1655
( Reacción heterogénea en
benceno( Los alcoholes 1º son oxidados a
ácidos( Los alcoholes 2º son oxidados a
cetonas( Los múltiples enlaces no son
oxidadosPermanganato de Bario (Ba(MnO4)2),
TL 1978, 839
( Oxidación de 1º y 2º alcoholes a
aldehídos y cetonas. NO hay
sobreoxidación( Los múltiples enlaces no son
oxidados( Similar en reactividad al MnO2.
Dióxido de Manganeso, (MnO2)
Review: Synthesis 1976, 65,
133

1.3.1.3. Oxidación con reactivos de
RuthenioTetróxido de Ruthenio
(RuO4)
( Efectivo para la conversión de alcoholes
1º a RCOOH y alcoholes 2º a cetonas( Oxida enlaces múltiples y 1,
2-dioles
Ph3P)4RuO2Cl3, RuO2(bipy)Cl2.
Oxida una amplia gama de
alcoholes 1 º y 2 º a aldehídos y
cetonas sin oxidación de enlaces
múltiples.
Tetra- n – propilamonio Perrutenato
(TPAP, nPr4N+RuO4- )
Aldrichimica Acta 1990, 23, 13
Synthesis 1994, 639( Oxidación suave de alcoholes a cetonas y
aldehídos, sin sobreoxidación
(Ba [Ru(OH)2O3]
( Oxida sólo los alcoholes más
reactivos (bencílico y alílico)(Ph3P)3RuCl2 + Me3SiO-OSiMe3
( Oxidación de alcoholes bencílico y
alílico TL 1983, 24, 21851.3.1.4. Oxidación con reactivos de
Paladio. La oxidación de alcoholes secundarios
(deshidrogenación) con carbonatos de alilo y
catalizada por Pd (0), es un buen método de
laboratorio para formar cetonas impedidas. (Oxidación
de Tsuji)
1.3.1.5. Oxidación con reactivos de
plata
El procedimiento normal para la conversión de
alcoholes a cetonas y aldehídos en la industria, es la
deshidrogenación catalítica. El oxígeno
atmosférico convierte los alcoholes primarios en
ácidos y los secundarios en cetonas. La
reacción es muy lenta, a menos que se añadan
radicales libres como iniciadores.1.3.2. Oxidación de alcoholes
terciariosPara la oxidación de los alcoholes terciaros
se requieren condiciones drásticas, ya que implica la
ruptura del enlace C–C. Los productos que resultan al
reemplazar por oxidación todos los átomos de
hidrógeno adicionados a los átomos de carbono
son ácidos ó cetonas.En estas roturas degradativas se usan frecuentemente
las soluciones calientes de trióxido crómico,
que es la etapa clave del método
Barbier–Wieland, para la degradación escalonada
de ácidos carboxílicos. Se han efectuado
algunas aplicaciones de este método en
síntesis.Ejemplo:

1.3.3. Otros agentes oxidantes de
alcoholesDMSO activado.
Synthesis 1981, 165; 1990, 857
Organic Reactions 1990, 39,
297

Oxidación de alcoholes 1º y 2º,
con DMSO. La oxidación de alcoholes por
dimetilsulfóxido (DMSO), permite la
conversión de alcoholes 1 º y 2 º a
aldehídos y cetonas respectivamente. Una fuente de
oxígeno que ha demostrado ser eficaz para la
oxidación de alcoholes es el DMSO. Debido a la
naturaleza exotérmica de la reacción, por
lo general funcionan a -50 º C o inferior. Los
co-solventes tales como cloruro de metileno o THF son
necesarios, puesto que el DMSO puro se se congela a 18
º.
En algunos casos se añade trietilamina para
proporcionar una base adicional. Se debe tomar en cuenta que
este procedimiento de oxidación es muy suave y tolera
una gran variedad de otros grupos funcionales, incluidos los
que tienen el nitrógeno oxidable y átomos de
azufre.
Oxidación de Swern. (El
anhídrido trifluoroacético puede ser
utilizado como agente activador del DMSO).

Oxidación de Moffatt (DMSO/DCC),
JACS 1965, 87, 5661, 5670

Oxidación con SO3/piridina.
JACS 1967, 89, 5505
Oxida selectivamente los
alcoholes menos impedidos
Oxidación de Corey-Kim (DMS/NCS),
JACS 1972, 94, 7586

Oxidación de Mukayama,
BCSJ 1977, 50, 2773

Oxidación de Dess-Martín
(DMP), JOC 1983, 48, 4155
JACS 1992, 113, 7277
El Dess-Martin periodinane es un reactivo
químico utilizado para oxidar alcoholes primarios a
aldehídos y alcoholes secundarios a cetonas. El
periodinane tiene varias ventajas sobre los oxidantes de
cromo y DMSO, debido a que se trabaja en condiciones
más suaves (temperatura ambiente, pH neutro), presenta
menor tiempo de reacción y tiene rendimientos
más altos. Por otro lado presenta tolerancia de grupos
funcionales sensibles, y posee una larga vida
útil.
Oxidación de Parikh –
Doering

Oxidación de Oppenauer.
Synthesis 1994, 1007 Organic
reactions 1951, 6, 207

Oxidación de alcoholes primarios con
formación de nitrilosOxidación con NH4HCO3/(Bu4N)2S2O8/Ni. La
oxidación de alcoholes primarios catalizada por
superficies de níquel con peroxidisulfato
tetrabutilamonio en presencia de carbonato ácido
de amonio en condiciones básicas acuosas, permite
acceder a diversos nitrilos alifáticos,
aromáticos y heterocíclicos, con excelentes
rendimientos y alta pureza.

F.-E. Chen, Y.-Y. Li, Xu M.,
H.-Q. Jia, Síntesis, 2002,
1804-1806.Oxidación con TCBDA/NH3, H2O. Los
alcoholes primarios disueltos en solución acuosa
de amoníaco, pueden transformarse exitosamente en
nitrilos por oxidación con el oxidante, N',
N'-tetraclorobenceno-1,3-disulfonamida
(TCBDA).

Oxidación con DIH/NH3, H2O. Varios
alcoholes primarios, y las aminas primarias, secundarias
y terciarias se convirtieron de manera eficiente en los
nitrilos correspondientes con buenos rendimientos por
oxidación con 1,3-diyodo-5,5-dimetil (DIH) en
solución acuosa de amoniaco a 60 °
C.

S. Iida, Togo H., Synlett,
2007, 407-410.Oxidación con Perruthenato de
tetrapropilamonio (TPAP o TPAPR).

El Tetróxido de rutenio solo, es un oxidante
muy agresivo, pero su derivado TPAP es un agente oxidante
para la conversión de alcoholes a aldehídos y
también puede ser utilizado para oxidar los alcoholes
primarios hasta llegar al ácido carboxílico a
través de un catalizador.El mecanismo funciona mediante una oxidación
normal del alcohol para el aldehído seguido de
hidratación, y una oxidación final.La
oxidación genera el agua que se pueden eliminar
mediante la adición de tamices moleculares.El TPAP es caro, pero se puede utilizar en
cantidades catalíticas. El ciclo catalítico se
mantiene mediante la adición de una cantidad
estequiométrica de una co-oxidante tal como
N-metilmorfolina N-óxido o el oxígeno
molecular.Oxidación de éteres..
La oxidación de éteres a
ésteres, es una reacción que ofrece muchas
posibilidades para la modificación de la funcionalidad
de compuestos de cadena abierta o sistemas
cíclicos.
Página siguiente  |