- Introducción
- Parte
Experimental - Instrumentos y
materiales - Cálculo de
DHN - Respuestas a las
preguntas del cuestionario - Conclusiones
sobre los resultados y análisis de posibles fuentes de
error.
Introducción
El objetivo de
este trabajo es
aplicar los conocimientos teóricos sobre termodinámica a un experimento real,
más precisamente determinaremos la entalpía de
neutralización (∆H) cuando reaccionan diferentes
ácidos
(fuertes y débiles) con una base.
El experimento consistirá en hacer las reacciones antes
mencionadas y medir la variación de temperatura,
para ello utilizaremos un calorímetro adiabático (no
intercambia calor con el medio) para asegurarnos que el
calor no se transfiera a través de las paredes del
recipiente y se disipe disminuyendo considerablemente la
precisión de la medición, la temperatura la mediremos con
un termómetro de mercurio
convencional.
La expresión para ∆H en un sistema a
presión
constante es:
∆H= m Cp ∆T
Donde:
∆H es la variación de entalpía
m es la masa del sistema homogéneo
Cp es la capacidad calorífica específica a
presión constante
∆T es la variación de temperatura
En cuanto a las unidades
La masa puede expresarse en gramos
Cp en calorías /gramos. Cº , en joules
/gramos. Cº o en Kilocalorías/gramos.
Cº
∆T en grados Celsius (Cº)
Dependiendo de en qué unidades estén expresadas
estas magnitudes: ∆H quedará en joules, en
kilocalorías o en calorías.
En el caso de la reacción de neutralización que
ocurrirá en el calorímetro durante nuestra
experiencia, Q = n . ∆H (donde n es el número de
moles)
Mientras que la expresión general es Q = m Cp
∆T
Y m = v § donde v es el volumen de
solucion y § es la densidad de la
misma (similar a la del agua )
Con estas expresiones llegamos a:
n . ∆H = v § Cp
∆T
donde:
n es el número de moles
∆H la entalpía de neutralización
(cal/mol)
V es volumen (ml)
§ la densidad de la solución (g/ml)
Cp la capacidad calorífica específica
(cal/gCº)
∆T el aumento de temperatura luego de la
neutralización (Cº)
Parte
Experimental
La parte experimental de este trabajo consiste en determinar
la entalpía de neutralización de tres reacciones
distintas entre ácidos y bases. Los ácidos que
utilizamos son ácido clorhídrico, ácido
sulfúrico y ácido acético, y la única
base utilizada fue hidróxido de sodio. Cada uno de estos
compuestos se encuentran en solución acuosa, poco
concentradas, y de normalidad conocida.
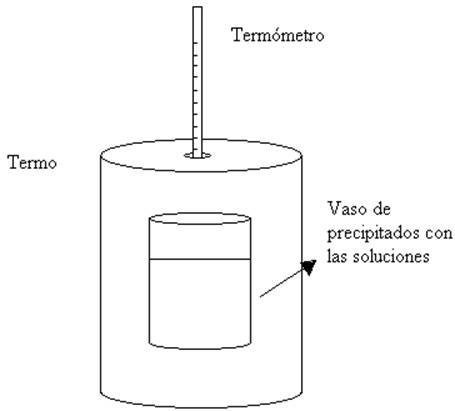
La reacción se llevará a cabo en un vaso de
precipitados, ubicado dentro de un termo que sirve como
calorímetro, y que, por ende, constituye un sistema
adiabático, en el cual no se intercambiará materia ni
energía con el medio
ambiente. La tapa del mismo tiene un orificio por el cual se
introduce un termómetro.
El esquema del calorímetro es el siguiente:
Instrumentos y
materiales
Utilizamos un calorímetro que consiste en un termo con
tapa, y un orificio (para el termómetro); un vaso de
precipitados de 150 ml., un termómetro de mercurio y una
probeta graduada de 100 ml.
Con el termómetro medimos las temperaturas de cada una
de las soluciones, y
la temperatura que se registra durante la reacción que se
produce dentro del calorímetro. En él, cada
marca
representa un grado centígrado, por lo que no pudimos
medir bien algunas temperaturas en que se requería mayor
precisión, lo cual es una fuente de error. Con la probeta
medimos los volúmenes necesarios de cada solución.
Aquí también, cada marca representaba 1 ml, por lo
que se nos hizo difícil medir volúmenes en que
necesitábamos una décima de mililitro. Creemos que
hubiese sido más conveniente utilizar pipeta, y así
tener mayor precisión. Finalmente, en el vaso de
precipitados es donde colocábamos las soluciones para que
se produjera la reacción.
Previo a utilizar cada uno de los materiales,
constatamos que estuviesen secos, ya que de lo contrario se
alterarían los volúmenes requeridos y las
concentraciones de las soluciones, además de influir
iones propios del agua que no debían estar presentes.
Procedimiento
En primer lugar, calculamos los volúmenes de cada una
de las soluciones de tal modo que las ácidas contengan 0,1
mol de H+ y la básica, 0,1 mol de
OH-, en base a la normalidad de cada sustancia. Por
ejemplo, el NaOH era 1,89 N, con lo cual:
1,89 moles de OH———–1000 ml
0,1 mol de OH- ———-52,9 ml.
De la misma manera con los tres ácidos, obtuvimos que
los volúmenes requeridos eran de: HCl: 58,1 ml;
H2SO4: 50 ml; CH3COOH: 43,47 ml;
NaOH: 52,9 ml.
A continuación, medimos los volúmenes con la
probeta y las temperaturas de cada una con el termómetro
(21˚ C para todas).
Pusimos el HCl en el vaso de precipitados, y este fue colocado
dentro del calorímetro. Ubicamos el termómetro, a
través del orificio, de modo tal que el bulbo quede en el
centro del volumen que ocupe la solución final, y vertimos
la solución básica en el vaso de precipitados,
cerrando inmediatamente el calorímetro. Registramos la
temperatura máxima que alcanzó el termómetro
(como la reacción de neutralización ocurre
rápidamente, esto fue realizado con rapidez). Luego, la
misma fue bajando hasta quedar en equilibrio con
la temperatura del interior del calorímetro, y finalmente,
con el exterior). Repetimos esto para los dos ácidos
restantes.
Página siguiente  |
