- Introducción
- Marco
teórico - Análisis de los resultados de las
tareas - Marco
metodológico - Conclusiones y
recomendaciones - Referencias
- Anexos
Introducción
Al momento que se analiza el entorno donde el hombre de
desarrolla, se observa que las plantas crecen, los animales se
trasladan y que las máquinas y herramientas realizan las
más variadas tareas. Todas estas actividades tienen en
común que precisan del concurso de la energía. La
energía es una propiedad asociada a los objetos y
sustancias, ésta se manifiesta en las
transformaciones que ocurren en la naturaleza como en los cambios
físicos, por ejemplo, al elevar un objeto, transportarlo,
deformarlo o calentarlo.
En este sentido, esta también está
presente en los cambios químicos, como al quemar un trozo
de madera o en la descomposición de agua mediante la
corriente eléctrica.
La energía puede manifestarse de diferentes
maneras: en forma de movimiento (cinética), de
posición (potencial), de calor, de electricidad, de
radiaciones electromagnéticas, etc. Según sea el
proceso
Se puede señalar también, que
la electricidad es una de las principales formas de
energía usadas en el mundo actual. Sin ella no
existiría la iluminación conveniente, ni
comunicaciones de radio y televisión, ni servicios
telefónicos, y las personas tendrían que prescindir
de aparatos eléctricos que ya llegaron a constituir parte
integral del hogar. Además, sin la electricidad el
transporte no sería lo que es en la actualidad. De hecho,
puede decirse que la electricidad se usa en todas partes. Tal es
el caso de Las baterías o pilas como
comúnmente se les conoce, que tiene más de 200
años de existencia, desde su
primer modelo primitivo hasta lo modernos
productos que existen en la actualidad, como pilas
alcalinas, pilas recargables, etc.
Para efectos de esta investigación, es importante
acotar que las pilas secas son un mecanismo que convierte la
energía química en eléctrica, Las pilas
primarias constan de productos químicos no pueden volver a
su forma original una vez que la energía ha sido
convertida, es decir, que las pilas se han descargado. Al
analizar esta situación nos lleva a concluir en algunas
dudas como lo es el hecho de saber ¿dónde surge
este curioso invento? ¿Cómo está
estructurada una pila? ¿Cómo es su funcionamiento?
¿Qué voltaje nos pueden generar algunas de estas
pilas? ¿Cuáles son las magnitudes
eléctricas? Estas interrogantes generan una serie de
objetivos en los cuales basaremos la
investigación.
OBJETIVOS DE LA INVESTIGACIÓN
Objetivo General
Demostrar el funcionamiento de una pila a
través de una maqueta
Objetivos específicos
Investigar la evolución histórica de
la pila y los diferentes tipos de pilas que
existen.
Tareas:
1. Revisión documental en la biblioteca
Rómulo Gallegos.2. Investigación en material
online.3. Recorrido por diversas ferreterías
para observar las pilas que se encuentran en el
mercado.
Describir la estructura interna de una pila a
través de una maqueta explicativa.
Tareas:
1. Revisión documental del material
investigado.2. Realización del boceto de la maqueta
explicativa.3. Compra de los materiales necesarios para la
elaboración de la maqueta.4. Elaboración de la maqueta
explicativa.
Explicar el funcionamiento de la pila utilizando
como recurso una maqueta.
Tareas:
1. Revisión documental del material
investigado.2. Resolver un ejercicio donde se calcule la
cantidad de wats que genera una pila.3. Organización de la exposición
dentro del aula de clases.
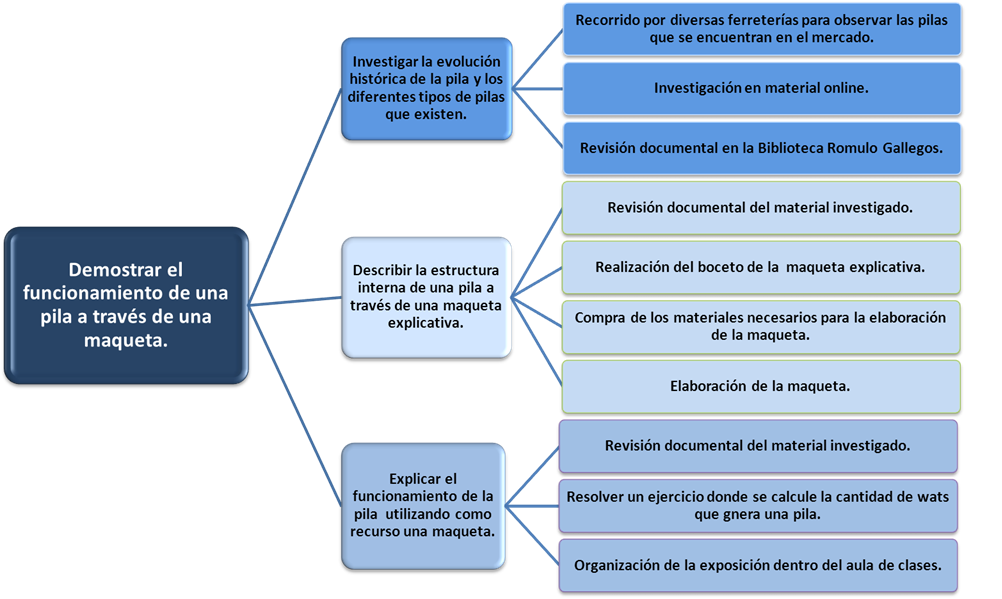
ÁRBOL DE
OBJETIVOS:
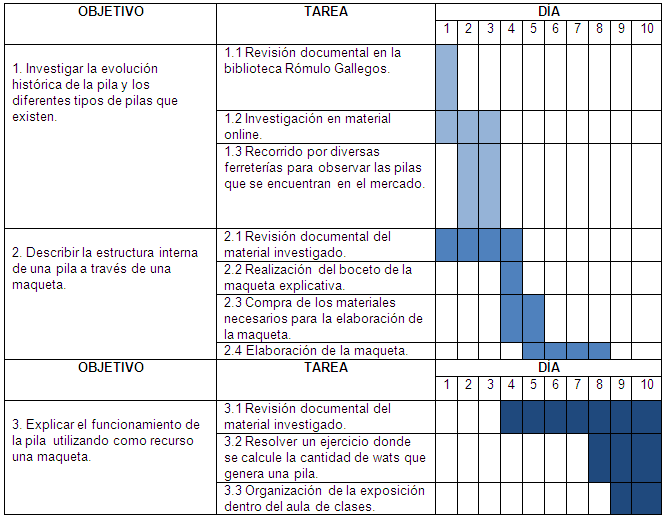
CRONOGRAMA DE TAREAS:
Marco
teórico
EVOLUCIÓN HISTÓRICA DE
LA PILA
Alrededor de los años 1800, El profesor de
filosofía natural en la universidad de Pavia Alessandro
Volta, creador de la unidad de medición de
la diferencia de potencial o voltios, construyó el
primer aparato conocido que generó corriente
continua. Lo que hizo fue poner dos pequeños discos del
tamaño de una moneda pequeña, uno de plata y el
otro de zinc en un recipiente, separados por un material
esponjoso como el cuero. Todo este conjunto estaba sumergido en
agua salada o en otra solución alcalina. A este conjunto
le podemos llamar una pila. Volta después de dio cuenta de
que si ponía estas pilas una seguida de otra, unidas por
tiras de metal se lograba que el voltaje final fuera
mayor.
En 1813, Sir Humphrey Davy conecto una batería
gigante en el sótano de la Sociedad Real Británica.
Esta batería estaba hecha de 2,000 pares de platinas y
tenía el tamaño de más o menos 100 m2. Con
esta batería realizó muchos experimentos que
permitieron un más profundo conocimiento de la naturaleza
de la electricidad.
Poco a poco los científicos fueron mejorando la
idea original de la batería de Volta y en 1860 George
Leclanche de Francia desarrollo la primera batería
utilizada ampliamente (la célula de zinc carbón) El
ánodo era de zinc y una aleación de mercurio y el
cátodo era un compuesto de dióxido de magnesio y un
poco de carbón. Ambos: ánodo y cátodo fueron
sumergidos en una solución de cloruro de amonio, que
actuaba como electrolito. El sistema fue llamado: "la
célula mojada". Aunque la idea de Leclache era barata fue
desplazada en 1880 por la célula seca.
En el año 1920 un joven científico, Samuel
Rubén y un también joven empresario llamado Philip
Rogers Mallory se conocieron cuando Rubén visitó la
fábrica de Mallory buscando un equipo que necesitaba para
un experimento. Juntos vieron el futuro en sus proyectos y
unieron la inventiva de uno con el poder de manufactura del otro.
Esta unión que se mantuvo hasta la muerte de Mallory en
1975 fue la base de la empresa que todos conocen
como Duracell International.
Las invenciones de Samuel Rubens
revolucionaron la tecnología de las baterías. El
creo la célula de mercurio que era mucho más
eficiente que la que se utilizaba antes de zinc carbón.
Este invento fue especialmente útil en la segunda guerra
mundial.
En el año 1950 Samuel Rubén
mejoró la batería alcalina de magnesio
haciéndola más resistente, compacta y de una gran
duración.La empresa Kodak introdujo
cámaras con flash incorporado y necesitaba este tipo de
pilas pero en el tamaño AAA. La empresa Mallory las
creó.
Tipos de pilas
Las pilas pueden ser de forma cilíndrica,
prismática o de forma de botones, dependiendo de la
finalidad a la cual se la destine. Existen muchos tipos de pilas,
estas en resumidas palabras se dividen en las primarias o
pilas que son aquellas que una vez agotadas no es posible
recuperar el estado de carga. Y las secundarias o
baterías, son las que en las que la transformación
de la energía química en eléctrica es
reversible, por lo que se pueden recargar. Por tanto la cantidad
de residuos generados es mucho menor.
Su categoría se señala con letras que
normalmente vienen impresas en las pilas. La mayoría de
las pilas y baterías contienen sustancias que hacen que,
una vez estos productos llegan al final de su vida útil,
se conviertan en residuos peligrosos. Entre los elementos
peligrosos para la salud y ambiente que éstas pueden
contener se encuentran el mercurio, plomo y cadmio. A
continuación se mencionan algunos de los tipos de pila que
existen hoy día en el mercado:
Zinc carbón: Son las pilas comunes, las
llamadas secas, estas se fabrican desde principio de siglo. Se
conocen también como pilas salinas o
de leclanché. Estas constan de 5 unidades
principales: la mezcla despolarizada, la pasta gelatinosa, el
elemento de carbono, la capa de zinc y elemento
sellado. Estas pilas contienen muy poco mercurio (aproximadamente
0,01%) o directamente no contienen. En este saco se comercializan
con designación que hacen referencia a estas
características como "verdes", "ecológicas",
"green".
Pilas alcalinas: Son de larga duración o
larga vida. Casi todas viven blindadas, sirven para aparatos
complejos, de alto consumo. Contienen el 0,04% de mercurio,
electrodo positivo o ánodo está formado
por zinc dividido, mientras que el cátodo
contiene dióxido de magneto. Electrolito es un alcal, de
donde viene el nombre de pilas alcalinas.
Pilas en miniaturas o pilas
botón: Son chatas, redondas y de
tamaños reducidos, como botones. La industria
electrónica requiere de ella, dad vez más. Se
utilizan para audífonos, marcapaso, aparatos
médicos, relojes y calculadoras. Entre ellas se puede
encontrar.
Pilas botón de mercurio: pueden
identificarse con la sigla MR. Garantizan
energía por largo tiempo, contienen un 30% de
mercurio.Pilas botón de zinc-aire: Se las distingue
por tener gran cantidad de agujeros diminutos en su
superficie, fue concebida a principios de los 70´ como
alternativa a las pilas botón de mercurio como ofrece
mejores prestaciones y mayor capacidad, pero cuenta con una
importante limitación como que para funcionar debe
estar en contacto con el aire, por lo que sus aplicaciones
son registradas. En el campo de la medicina, estas pilas
ocupan prótesis mecánicas.Pilas botón litio: Son las más grandes
tipo botón. Producen tensiones altas de 3 rilteos.
Sirven para calculadoras y relojes.Pilas botón de oxido de plata: Son diminutas
y se distinguen por la sigla SR se las encuentra muy poco en
los comercios ya que por su alto precio no constituyen una
alternativa económica, contienen 1% de
mercurio.
Pilas de nicad níquel y cadmio: Recientemente se
ha empleado con mayor frecuencia un nuevo tipo de pila
seca-Nicad que puede ser recargada, por lo tanto tiene una
vida útil mucho más prolongada que las pilas secas
comunes(leclanché) – Se emplean en calculadoras, pulseras,
relojes y equipos fotográficos. El ánodo es de
cadmio y cátodo de óxido de
níquel.
Partes de una pila
A continuación se describen las partes internas
que conforman una pila seca, con su función, visible
también en el anexo A
Contenedor: Es el recipiente de acero que contiene los
ingredientes de la pila y que forma el cátodo, una parte
de la reacción química.
Cátodo: es el electrodo negativo, en el cual los
iones (átomos cargados eléctricamente) qué
se dirigen del ánodo al cátodo reciben el nombre de
cationes, es una mezcla de dióxido de manganeso y
carbón. Los cátodos son electrodos reducidos por
una reacción química.
Ánodo: es el terminal positivo en que la
corriente eléctrica viaja en sentido positivo al negativo
por el circuito externo, o sea transportada por cargas positivas.
Es el zinc metal en polvo, son electrodos que se oxidan. Los
iones que se dirigen del cátodo al ánodo tienen el
nombre de aniones…
Separador: es el que se encuentra entre
ánodo y cátodo es de una capa no-tejida de
celulosa o de un polímero sintético. El separador
debe permitir el paso de los iones y permanecer estable en la
disolución de electrolito altamente alcalina.
Electrodos: es donde se lleva a cabo la
reacción Electro-Química
Electrolito: es una solución de hidróxido
de potasio en agua. El electrolito es el medio para el movimiento
de los iones dentro de la celda y lleva la corriente dentro de la
pila.
Colector: es un alfiler de bronce en el medio de la
celda que conduce la electricidad hacia el circuito
exterior.
Funcionamiento de una pila
seca
El funcionamiento de una pila es sencillo, consiste
básicamente en introducir electrones en uno de los
extremos de un alambre y extraerlos por el otro. La
circulación de los electrones a lo largo del alambre
constituye la corriente eléctrica. Para que se produzca,
hay que conectar cada extremo del alambre a una placa o varilla
metálica sumergida en un electrolito que suele ser una
solución química de algún compuesto
iónico. Cuando ese compuesto se disuelve, las
moléculas se dividen en iones positivos y negativos, que
se mantienen separados entre sí por efecto de las
moléculas del líquido. El electrolito que
utilizó Volta era ácido sulfúrico; cada una
de sus moléculas, al disolverse en agua, se descompone en
dos protones H+ (iones positivos) y un ion
sulfato SO4- (ion negativo). Las varillas
metálicas de cobre y cinc constituyen los electrodos, que
deben ser sumergidos en el electrolito sin que lleguen a entrar
en contacto. La placa de cobre es el electrodo positivo o
ánodo y la placa de cinc el electrodo negativo o
cátodo.
Al reaccionar el electrolito con las varillas se produce
una transmisión de electrones, que han sido
extraídos de la placa de cinc, hacia la placa de cobre,
con lo que los átomos de cinc son oxidados e incorporados
a la disolución, según la
reacción:
Zn —> Zn2++
2e-
Esto ocurre así y no al revés, del cobre
al cinc, porque los átomos de cinc tienen más
tendencia que los de cobre a ceder electrones.
En la varilla de cobre se produce una reducción
de los iones hidrógeno H+ de la
disolución, ya que los electrones liberados por los
átomos de cinc recorren el hilo conductor hacia la placa
de cobre y son captados por los H+, que se convierten en
átomos de hidrógeno y escapan en forma de gas.
Estos electrones en movimiento son los que originan la corriente
eléctrica.
Por su parte, los iones SO4- reaccionan
con los cationes Zn2+ y se convierten en
moléculas de sulfato de cinc.
2 H~+2e —> H2
Zn2+ + SO42- —> ZnSO4
Cuando se corta la conexión exterior entre las
placas, los electrones no pueden desplazarse a lo largo del hilo
de una placa a ¡a otra, con lo que se interrumpe la
reacción. Este fenómeno es visible y explicado
gráficamente en el Anexo B.
El dispositivo funciona mientras existan átomos
de cinc para formar el sulfato correspondiente. Cuando la placa
de cinc se ha desintegrado por completo ya no puede producirse la
reacción, por lo que la pila ya no tiene uso. Por este
motivo, las pilas de este tipo reciben el nombre de pilas
primarias.´
Magnitudes eléctricasLa
electricidad tiene tres magnitudes, que si bien, no son visibles,
pero si son cuantificables, estas son:
Voltaje: Es la fuerza con la que circula la
electricidad, su unidad es el voltio (V) y para medirlo se
utiliza el voltímetro. El voltio es la unidad principal de
medida del voltaje, pero tiene múltiplos y
submúltiplos y las unidades de equivalencia para el
voltaje se describen a continuación:
Milivoltio ( mv ) 0,001 V.
Voltio ( V ) 1 V.
Kilovoltio (Kv) 1.000 V
Intensidad: Es la cantidad de electricidad que circula
por un conductor en un tiempo determinado y depende
principalmente del consumo del receptor, su unidad es el amperio
(A) , para medirlo se utiliza el amperímetro.
La intensidad se mide en serie para cualquier circuito
eléctrico, el cable positivo al que lleva la corriente y
el cable negativo al que va hasta el receptor.las unidades de
equivalencia de la intensidad son:
Amperio (A) 1 A
Miliamperio ( ma ) 0,001 A
Microamperio (&µa) 0,000001 A
El amperio es una unidad muy grande, ( es el
desplazamiento de unos 6 trillones de electrones en un segundo )
y no tiene múltiplos, pero sí que se utilizan
submúltiplos.
Voltaje de las pilas secas
Resulta que las pilas se fabrican en
diferentes estándares definidos, de tal manera que su
utilización sea universal según los requerimientos;
o sea un aparato que dice necesitar pilas "AA" esta consiste en
una celda electroquímica de 51 milímetros da largo
(sin considerar el terminal en fobvºrma de botón),
con alrededor de 14 milímetros de diámetro. El
voltaje de la pila AA es de aproximadamente 1,5 Volts o en el
caso de las recargables 1,2 Volts. Lo que varía es su
capacidad; esta se mide en miliamperios por hora, que es la
medida mAh en la pila, lo que determina su duración y uso.
La pila AAA, es un estándar, tal como en el caso anterior,
pero de menor tamaño, típico para controles
remotos. Esta mida 44,5 milímetros de largo, con un
diámetro de 10,5 milímetros, y tiene también
1,5 Volts, tal como la AA y las recargables entregan 1,2Volts. Su
capacidad es menor, estando en los 1000 mAh, un poco más o
un poco menos, lo que las hace apropiadas para aparatos de menor
consumo.
Análisis
de los resultados de las tareas

Marco
metodológico
Esta investigación está estructurada por
una introducción, objetivos generales y especifico,
seguido de un árbol de Objetivos donde se señalan
las tareas a realizar, mas explicadas en el cronograma de tareas,
luego el marco teórico y el marco metodológico con
su estructura enmarcada, consecutivamente el análisis de
los resultados obtenidos de las tareas, las conclusiones y
recomendaciones, seguida de las referencias bibliográficas
y para finalizar los anexos.
Para logar los objetivos planteados en esta
investigación, se formularon una serie de tareas descritas
a continuación
Objetivo 1. Investigar la evolución
histórica de la pila y los diferentes tipos de pilas que
existen.
Tarea: 1.1. Revisión documental en la biblioteca
Rómulo Gallegos:
Los investigadores se trasladaron a la Biblioteca
Nacional Rómulo Gallegos, ubicada en la avenida
Bolívar de San Juan de los Morros con el fin de recaudar
información en los textos allí disponibles
referentes a la evolución histórica, tipos de
pilas, entre otros.
Tarea 1.2 Investigación en material
online.
Se reviso desde una computadora el material disponible
en distintas páginas web con el fin de recaudar
información la obtenida referente a la evolución
histórica, tipos de pilas, entre otros.
Tarea 1.3 Recorrido por diversas ferreterías para
observar las pilas que se encuentran en el mercado.
Los investigadores se trasladaron por distintas
ferreterías y tiendas ubicadas en el centro de San Juan de
los Morros con el fin de observar y analizar cuáles son
realmente las pilas que se encuentran en el mercado.
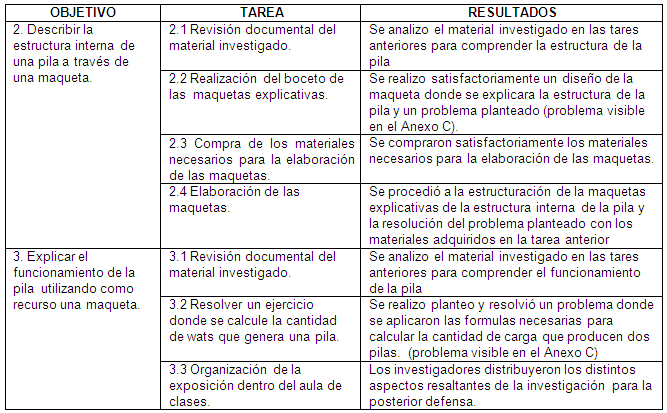
Objetivo 2. Describir la estructura interna de una pila
a través de una maqueta
Tarea 2.1 Revisión documental del material
investigado.
Se procedió al análisis del material
investigado en las tares propuestas en el objetivo anteriores,
para así comprender la estructura de la pila y poder
elaborar la maqueta
Tarea 2.2 Realización del boceto de las maquetas
explicativas.
Los investigadores realizaron un diseño,
utilizando hojas blancas y lápices de colores con la
posible representación de la estructura de la pila en la
maqueta, y la manera en la cual se colocaran los objetos
necesarios para la explicación de la el ejercicio
planteado.
Tarea 2.3 Compra de los materiales necesarios para la
elaboración de la maqueta.
Se compraron en la ferretería Casa Castillo,
ubicada en la avenida Bolívar de San Juan de los morros
los siguientes materiales: Hilo de cobre, pilas, imán, 2
laminas de anime, pinturas, pega, y se imprimieron
imágenes necesarias para elaborar las maquetas
Tarea 2.4 Elaboración de la maqueta.
Los investigadores reunidos procedieron a la
elaboración de las maquetas explicativas de la estructura
interna de la pila, y el ejercicio planteado, según los
bocetos realizados en la tarea 2.2, utilizando los materiales
adquiridos en la tarea 2.3.
Objetivo 3. Explicar el funcionamiento de la pila
utilizando como recurso una maqueta.
Tarea 3.1 Revisión documental del material
investigado
Se reviso y analizo el material recaudado, con el fin de
comprender como es el funcionamiento de una pila, y puntualizar
cuales son las formulas físicas para el cálculo del
voltaje eléctrico que estas generan
Tarea 3.2 Resolver un ejercicio donde se calcule la
cantidad de wats que genera una pila.
Los investigadores plantearon luego del análisis
de la información recaudada, una situación en la
que se aplique la fórmula del cálculo de Wats que
generan 2 pilas, posteriormente resuelto y expuesto en el Anexo C
y en la maqueta numero 2
Tarea 3.3 Organización de la exposición
dentro del aula de clases.
Los investigadores distribuyeron todos los aspectos de
la investigación para la posterior defensa en el aula de
clases.
Conclusiones y
recomendaciones
Luego de recolectar y analizar una amplia gama de
información, a través de una serie de tareas
planteadas para el logro de los objetivos propuestos, se puede
concluir con que se denomina pila a un sistema
compuesto por diversos elementos físicos y químicos
necesarios para desencadenar una reacción química
que al transformarse en energía eléctrica genera un
voltaje útil para el uso cotidiano de la
sociedad.
Como se observo durante la investigación existen
muchos tipos de pilas y baterías, que luego de un
desarrollo a través de la historia se llego a lo se ve en
el mercado hoy en día, se analizo la estructura
física y el complejo proceso de transformación de
la energía de algo tan común como una simple pila ,
esta genera distintos voltajes según su estructura interna
y que se encuentra en el mercado a disponibilidad de cualquier
consumidor, aunque también se observo que es un
artículo de mucha utilidad, pero con efectos contaminantes
al medio ambiente ya que Según estudios especializados,
una pila de mercurio puede llegar a contaminar 600.000
litros de agua, una de zinc 12.000 litros, una de
óxido de plata 14.000 litros y una pila común
3.000 litros si deja mal ubicada en algún lugar expuesto
al medio ambiente. Al descomponerse la capa protectora que
recubre una pila, se liberan los metales que contienen
y entonces se produce la contaminación.
Se recomienda darle el uso adecuado a este objeto de
tanta utilidad y desecharlo en los lugares correspondientes, para
evitar la contaminación del medio ambiente, y dar a
conocer más el funcionamiento y estructura interna de la
pila a través de de recursos didácticos como la
maqueta, ya que es más complejo de lo que
comúnmente se cree.
Referencias
Arias, F. (2006). El proyecto de
investigación. Caracas. Episteme.
Fernández Mills, G; Fernández
Ferrer, J.(1993). Electricidad, teoría de circuitos y
magnetismo.1ª ed. Edición UPC: Aula ETSEIB,
4.
Guerrero I. (2005) La pila o batería
(Pila casera) Disponible en:
http://www.monografias.com/trabajos26/la-pila/la-pila#biblio
Hann, Judith.(1981). Los amantes de la
ciencia. 1ª ed. Ed Blume.
Material Online. Historia de la pila
Disponible en:
http://www.energizer.cl/learning-center/battery-history
Tipler.(1994) Física. Vol II.
Traducción de la tercera edición Nord-Americana. Ed
Reverté.
Anexos
ANEXO A
Explicación grafica de las partes internas de
una pila seca

ANEXO B
Explicación grafía del funcionamiento
de una pila seca

ANEXO C
Problema resuelto en la tarea 3.2
Calculo de la cantidad de la carga en Wats que producen
dos pilas secas.
Voltios (1,5) x Cantidad de pilas x Los Amperios
(0,3)
1,5x2x0,3= 0,9W —-> Eso son los wats que producen
las dos pilas.
Ese resultado se transforma a kwh (kilo wats
hora)
Es decir;

Autor:
Mariana Castillo
