- Definición de materia
- Composición de la
materia - Propiedades de la materia
- Cambios de estados de la
materia - Clasificación de la
materia - Bibliografía
Desde 500 años a. C., los sabios
griegos fueron los primeros en pensar acerca de la materia,
específicamente de que (composición) y como estaba
formada (estructura). Ellos afirmaban que la materia estaba
referida a la tierra, viento, fuego y aire; así mismo, el
griego Leucipo afirmo acertadamente que la materia estaba formada
por partículas, a las cuales su compatriota
Demócrito llamo átomos.
Hoy en día se sabe que la materia es
todo aquello que se puede ver a simple vista, como un
lápiz, y lo que no se puede ver a simple vista, como el
aire y las bacterias; también es materia lo que constituye
los planetas, el sol, las demás estrellas, las galaxias y,
a escala microscópica, las células, los virus, el
ADN, etc.
Desde aquel entonces la materia ha sido
objeto de estudio, lo cual se sigue haciendo tanto en la tierra
como en el espacio exterior.
Definición de
materia

Composición de
la materia
Decir composición es como decir "de
que está formada una cosa u objeto". Esto se refiere a que
la materia está formada o compuesta por algo, y ese algo
son unas partículas no-visibles a simple vista llamadas
átomos.

Ahora bien, existe una clase de materia
llamada elemento químico, como el oro, la cual está
formada por un solo tipo de átomos; y también
existe otra clase de materia conocida como compuesto
químico, como el agua y el vinagre, las que están
formadas por dos o más tipos de átomos unidos, a lo
cual se le denomina molécula. Entonces, la
partícula más pequeña de un elemento
químico es el átomo, y la partícula
más pequeña de un compuesto químico es la
molécula.

Propiedades de la
materia
Existe algo que nos permite identificar y
distinguir un objeto de otro, lo cual recibe el nombre de
propiedad. Esto es que, una propiedad es una
característica o atributo de un objeto o una sustancia que
permite clasificarla como igual o distinta a otra; en otras
palabras, una propiedad es una cualidad que puede ser apreciada
por los sentidos, por ejemplo el color, la dureza, el peso,
etc.
Existen propiedades que son comunes a todos
los tipos de materia, las cuales reciben el nombre de
propiedades generales, como por ejemplo la masa;
así mismo, existe otro grupo de propiedades que permiten
diferenciar a una clase de materia de otra, las cuales se conocen
como propiedades específicas, tales como el
sabor.
Las propiedades de la materia se clasifican
de diversas maneras: en generales y específicas, en
extensivas e intensivas y en físicas y químicas.
Las propiedades generales dependen de la cantidad de materia del
objeto o cosa en estudio, como por ejemplo su peso y volumen; y
las propiedades específicas dependen de la clase o tipo de
materia del objeto de que se trate, como por ejemplo su dureza y
densidad.
Mas propiedades generales de la materia son
el peso, volumen, forma, tamaño, inercia, impenetrabilidad
y divisibilidad; y entre otras propiedades específicas
están: color, sabor, olor, dureza y
conductividad.

Descripción de algunas
propiedades generales.
Las propiedades generales se llaman
así porque están presentes en todos los tipos de
materia. Estas propiedades dependen
únicamente de la cantidad de materia y no de la calidad
o
clase de la misma. Entre ellas
están:
– Masa. Todo lo que es
materia posee masa, y esta se define como "la cantidad de
materia que posee un cuerpo u
objeto".
Los cuerpos u objetos pueden cambiar su
forma pero su masa será siempre la misma; cierta
cantidad de agua puede cambiar de forma, según sea
la forma del recipiente que la contenga,
pero su masa seguirá siendo la
misma.
– Peso. Se define como"
la fuerza con que la tierra atrae a un determinado
cuerpo".
El peso no es lo mismo que la masa; el peso
no es una cantidad de materia u otra cosa que se
pueda ver, sino que es una fuerza, específicamente
una fuerza de atracción que la tierra ejerce
sobre todas las cosas que están por encima de ella,
de tal manera que las mantiene adheridas a su
superficie, evitando así que salgan "volando"
involuntariamente hacia el espacio exterior; esta
fuerza de atracción recibe el nombre de "fuerza de
gravedad", que tiene un símbolo y valor: g =
9.8 m/s2
La fuerza de gravedad es la misma para
todas las cosas que residen sobre la tierra, pero el
peso si es distinto, pues este va variando según sea
la masa del cuerpo u objeto en estudio.
Para calcular el peso de un
cuerpo es necesario conocer la masa y la gravedad, las cuales se
relacionan mediante el planteamiento o formula
siguiente:
P = m x g
P = peso
m = masa
g = gravedad
A medida que un organismo u objeto se aleja
de la tierra, entonces menor es su peso, pues la tierra ejerce
menos fuerza de atracción sobre él. Esto significa
que, la masa de los objetos no cambia, pero si su peso,
dependiendo de la altura a la que se encuentren.
– Volumen. Toda materia
ocupa un espacio, el cual tiene tres dimensiones (tridimensional)
o lados que pueden medirse: ancho, largo y altura. Estos tres
lados forman un solo espacio conocido como volumen. En otras
palabras, el volumen "es la cantidad de espacio ocupado por un
cuerpo".
El volumen representa a la cantidad de
espacio que ocupa la materia de un cuerpo. Sin embargo, el
volumen tiende a confundirse con el termino de capacidad, los
cuales están muy relacionados entre sí, pero no
significan lo mismo. Cuando un objeto está hueco o posee
una concavidad, ésta puede rellenarse con otra sustancia,
es decir, ciertos cuerpos tienen la capacidad de contener a otros
cuerpos; por ejemplo, una botella o un vaso se pueden llenar de
un líquido o de un gas. La cantidad de líquido o
gas que puede contener la botella o vaso se llama capacidad;
así, la capacidad es "el volumen de un cuerpo que
tiene cabida en el hueco existen te de otro
cuerpo".
Un ejemplo de volumen y capacidad es el
siguiente: un tanque elevado de cemento mide 10 metros de ancho,
12 metros de largo y 3 metros de alto, por lo que su volumen o
espacio ocupado es igual a 360 metros cúbicos. Ahora bien,
este tanque es un cuerpo hueco y por ello puede contener a otro
cuerpo sólido, liquido o gaseoso; la cantidad que pueda
contener este tanque es lo que se conoce como
capacidad.
El volumen de ciertos cuerpos o sustancias,
como por ejemplo los gases, puede cambiar, según sea la
temperatura, la presión, el estado físico del
cuerpo, etc.
Descripción de algunas
propiedades específicas.
Estas propiedades se utilizan para
establecer diferencias cualitativas (de calidad) entre los
cuerpos u objetos, y se dividen a su vez en propiedades
físicas y químicas. Entre las primeras
están el punto de fusión y el
punto de ebullición.
– Punto de fusión.
Es la temperatura a la cual una sustancia solida cambia a
estado líquido.
El agua en estado sólido (hielo)
logra cambiar a estado líquido cuando se encuentra a
una temperatura de cero grados centígrados (O
oC), o sea que, el punto de fusión del hielo es
de
cero grados centígrados.
– Punto de
ebullición. Este término es
sinónimo de hervir, y se define como "la temperatura a
la cual una sustancia liquida cambia a estado gaseoso".
Por ejemplo, el punto de ebullición
del agua líquida es de 100 ºC (grados
centígrados), pues a esta temperatura logra hervir para
cambiar a estado gaseoso; el alcohol hierve a 78 ºC y el
hierro lo hace a 2,750 ºC. Cada sustancia tiene su propio
punto de fusión y ebullición, tal como se muestra a
continuación:
PUNTOS DE FUSION Y EBULLICION DE
ALGUNAS SUSTANCIAS
SUSTANCIA | PUNTO DE FUSION (0C) | PUNTO DE EBULLICION (0C) |
AGUA ALCOHOL HIERRO COBRE ALUMINIO PLOMO MERCURIO | 0 -117 1,539 1,083 660 32 – 39 | 100 78 2,750 2,600 2,400 1,750 357 |
– Densidad. Esta
propiedad permite saber si un objeto o cuerpo es liviano o
pesado, o más bien
si tal objeto flotara o se hundirá
al colocarlo en un líquido como el agua. La densidad de un
ob-
jeto se puede calcular a partir de su masa
y volumen (2), utilizando la formula siguiente:

La densidad se define como "la cantidad de
masa que existe en un determinado espacio o
volumen", esto es que, la densidad señala la
cantidad de masa que se requiere para llenar o ocu
par una unidad de volumen.
Dos objetos distintos con igual masa
ocuparan volúmenes diferentes y, por lo tanto,
tendrán densidades distintas; así
mismo, los cuerpos u objetos con masa diferentes ocuparan
también
volúmenes diferentes, por lo cual
sus densidades serán similares o distintas.
DENSIDAD DE ALGUNOS COMPUESTOS Y
ELEMENTOS QUÍMICOS
SUSTANCIA | DENSIDAD | DENSIDAD |
Agua Aceite Gasolina Plomo Acero Mercurio Madera Aire Butano Dióxido carbono | 1000 920 680 11300 7800 13600 900 1'3 2'6 1'8 | 1 0'92 0'68 11'3 7'8 13'6 0'9 0'0013 0'026 0'018 |
La densidad del agua tiene valor de 1, y
cuando la densidad de un cuerpo es menor que la del
agua entonces flotara, pero si su densidad es mayor que la
del agua entonces se hundirá. La densidad de
la madera es menor que la densidad del agua (0.5 g/cm3), por eso
la madera flota; pero la densidad del hierro es
mayor que la del agua (7.9 g/cm3), por eso el hierro se
hunde en esta última.
Los cuerpos pesados y que ocupan poco
espacio (hierro, plomo, etc.) tienen densidades mayores que la
del agua, y por eso se hunden; mientras que los cuerpos pesados o
livianos que ocupan bastante espacio ( como la madera) tienen
densidades menores que la del agua, y por eso flotan. En todo
caso, se debe utilizar la formula anterior cuando se desee saber
la densidad de un cuerpo u objeto, y el resultado debe compararse
con el valor de la densidad del agua, para así establecer
si el objeto en estudio es más pesado o liviano que el
agua, o si tal objeto flotara o se hundirá en tal
sustancia.
Los barcos están hechos de acero,
que es más pesado que el agua, y sin embargo no se hunden
porque estos tienen espacios vacíos, libres y llenos de
aire, lo cual les permite flotar; sin embargo, este aspecto es
otra situación o condición. La densidad de las
sustancias aumenta cuando lo hace la temperatura, excepto en el
caso del agua, que es lo contrario.
– Ductilidad. "Es la
facilidad que presentan algunos metales para transformarlos en
hilos".
Por ejemplo, el cobre es un metal que
fácilmente se le puede dar la forma de hilo o alambre,
tales como los que conducen la energía
eléctrica.
– Maleabilidad. Es la
facilidad que presentan algunos metales para transformarlos en
láminas
Tal es el caso del estaño que
fácilmente se le da la forma de lámina, con la cual
se fabrican envases metálicos o latas.
– Dureza. "Es la
resistencia que presenta un cuerpo a ser rayado".
Un cuerpo es más duro que otro si
logra rayarlo. Para establecer la dureza de un objeto se usa
habitualmente la escala de Mohs.
– Solubilidad. Varios
sólidos tienen la propiedad de disolverse bastante, poco o
nada en algunos líquidos. Por lo tanto, la solubilidad se
define como "la capacidad que tiene una sustancia para disolverse
en otra". La sal de mesa logra disolverse bastante en el agua,
por lo que su solubilidad es alta.
Una sustancia aumenta su solubilidad cuando
se aumenta la temperatura; sin embargo, la
solubilidad de los gases en los líquidos disminuye
al aumentar la temperatura.
d. Estados de la
materia.
Algunos autores se refieren a los estados
de la materia como "estados de agregación de la
materia",queriendo referirse con ello al grado de fuerza con que
los átomos se encuentran unidos o agregados en un objeto,
cuerpo o sustancia. En cierta clase de materia, los átomos
se encuentran fuertemente unidos, como en un anillo,
lápiz, taza, roca, etc.; en otras ocasiones, los
átomos están débilmente unidos, como es el
caso del agua, alcohol, vinagre, etc.; y en otra clase de
materia, los átomos ni siquiera están unidos, sino
esparcidos, como en los gases.
Con base en lo anterior, se dice que la
materia se presenta ante nuestros ojos en diferentes estados,
siendo los principales: solido, liquido, gaseoso y
plasma.
Existen otros estados de la materia, pero
que no son de interés para el presente texto,
como:
condensado de Bose-Einstein o CBE, predicho
en 1924 por Satyendra Nath Bose y Albert Einstein y obtenido en
1995; el condensado fermiónico, que es una fase
superfluida formada por partículas fermiónicas a
temperaturas bajas; fluidos supe críticos; coloide;
superfluido; super sólido; materia degenerada; neutronio;
materia fuertemente simétrica; materia débilmente
simétrica; plasma de quarks-gluones; materia
extraña o materia de quarks; etc.
El estado de la materia no es fijo, pues
depende de la temperatura a la que se encuentre. Así, el
agua se mantiene en estado líquido a temperaturas que van
de 0 a 99 oC , y en estado sólido o hielo a temperaturas
menores que cero; si la temperatura es igual o mayor que 100 0C,
entonces el agua se mantiene en estado gaseoso.
En general, según sea la fuerza con
que los átomos se encuentren unidos en un objeto o
sustancia, la materia se presenta en la naturaleza en 3 estados:
sólido, líquido y gaseoso.
Estado
sólido.

Un sólido es una sustancia formada
por átomos, iones o moléculas que se encuentran
fuertemente unidas entre sí por una fu- erza llamada
fuerza de cohesión*. Los sólidos son duros
y difíciles de comprimir porque sus moléculas
están muy unidas y no dejan espacio entre ellas, o sea que
no se pueden aproximar más; esto hace también que
los sólidos tengan una forma definida, que algunos flotan
y otros se hunden en el agua, y que su volumen sea casi
invariable.
La forma de los sólidos es
también invariable, porque sus partículas
(átomos, iones o moléculas) están
perfectamente ordenadas ocupando posiciones fijas en estructuras
tridimensionales repetitivas llamadas cristales. Las
partículas no están quietas en sus posiciones sino
que vibran sin cesar, tanto más intensamente cuanto mayor
es la temperatura; si ésta llega a ser lo suficientemente
alta (temperatura de fusión) las partículas pierden
sus posiciones fijas y, aunque siguen muy juntas, desaparece la
estructura cristalina, exclusiva de los sólidos, para
transformarse en líquidos.
La materia en estado sólido se
caracteriza por:
– Tener forma definida o fija.
– Tener volumen definido o fijo, pues no se
pueden comprimir como los gases.
– No fluir, como el agua. – Tener alta
densidad.
Estado
líquido.
Los líquidos son conocidos
también como fluidos. Un líquido es una sustancia
formada por moléculas que están en constante
desplazamiento y que se mueven unas sobre otras, y que
están más separadas que en los sólidos; la
forma de los líquidos es variable, es decir, no tienen
forma propia, por lo que toman la forma del recipiente que los
contienen. Los átomos, iones o moléculas
están débilmente unidas en las sustancias liquidas,
es decir, sus fuerzas de cohesión son muy débiles;
así mismo, el volumen de los líquidos casi no
varía, por lo que no se pueden comprimir, al igual que los
sólidos. En resumen, un líquido es toda sustancia
cuyas partículas pueden desplazarse y moverse unas sobre
otras, y que no tiene forma definida.
*cohesión= atracción entre
átomos o moléculas.
La materia en estado líquido se
caracteriza por:
– No tener forma definida o fija. Se
adaptan a la forma del recipiente que los contiene.
– Tener volumen definido o fijo. Son poco
compresibles.
– Fluir por sí misma. – Mezclarse
muy bien entre líquidos (miscibilidad).
– Tener densidad más alta que los
gases.
Estado gaseoso.

Las moléculas de un líquido
se mueven constante mente en el interior, pero se mueven
aún más cuando se les aumenta la temperatura, hasta
lograr abandonar la superficie del liquido para convertirse en
gas. Un gas es una sustancia formada por moléculas que
se encuentran separadas entre sí, dado que las
fuerzas de cohesión casi no existen o son demasiadas
débiles en el, por lo que las moléculas tienen
mucha libertad para moverse o escapar de los recipientes en que
se encuentran.
La materia en estado gaseoso no tiene forma
ni volumen definido, pues adopta la forma del recipiente que lo
contiene, ocupando todo su espacio. Las moléculas que
forman los gases se desplazan en varias direcciones,
expandiéndose a gran velocidad, por lo que ocupan grandes
espacios; así mismo, estas moléculas gaseosas puede
n comprimirse y así reducir su volumen, dado que estas
partículas no están unidas, sino
sueltas.
La materia en estado gaseoso se caracteriza
por:
– No tener forma definida o fija. Se
adaptan a la forma del recipiente que los contiene.
– No tener volumen definido o fijo. Ocupan
todo el volumen del recipiente que los contiene.
– Su volumen se modifica con los cambios de
temperatura presión.
– Ser fácilmente compresible. Los
gases no oponen resistencia a la presión.
– Difundirse con facilidad. Tienden a
mezclarse con otros gases.
Plasma.

El plasma es un estado que nos rodea,
aunque lo experimentamos de forma indirecta. El plasma es un gas
ionizado, esto quiere decir que es una especie de gas donde los
átomos o moléculas que lo componen han perdido
parte de sus electrones o todos ellos. Así, el plasma es
un estado parecido al gas, pero compuesto por electrones,
cationes (iones con carga positiva) y neutrones. En muchos casos,
el estado de plasma se genera por combustión.
El Sol situado en el centro de nuestro
sistema solar está en estado de plasma, no es
sólido, y los conocidos tubos fluorescentes contienen
plasma en su interior (vapor de mercurio). Las luces de
neón y las luces urbanas usan un principio similar. La
ionosfera, que rodea la tierra a 80 km de la superficie
terrestre, se encuentra también en estado de plasma. El
viento solar, responsable de las deliciosas auroras boreales,
también es un plasma. El fuego es plasma.
Los átomos normalmente están
en estado neutro: la carga positiva del núcleo es igual a
la carga negativa de los electrones. La agitación de un
gas aumenta cuando absorbe calor; si el calor absorbido es
suficiente, los electrones de los átomos son arrancados y
la materia queda ionizada, diciéndose que está en
estado de plasma. Es plasma todo gas incandescente formado por
átomos (a veces moléculas) convertidos en iones
positivos y negativos, y todo en continua agitación.
Dentro de ese gas pueden quedar también algunos
átomos y moléculas sin ionizar (partículas
neutras). Ejemplos de gases en estado de plasma son: algunas
zonas de las llamas o flamas, el gas de los tubos fluorescentes,
las luces de neón y el aire que se encuentra en el
recorrido de un rayo. La materia que forma las estrellas y
nuestro sol también se encuentra en estado de
plasma.
Al plasma se le llama a veces el cuarto
estado de la materia, además de los tres clásicos,
sólido, líquido y gas. Es un estado en el que los
átomos se han roto, y este queda formado por iones o
átomos que han perdido electrones y que están
moviéndose libremente.
En la baja atmósfera, cualquier
átomo que pierde un electrón (cuando es alcanzado
por una partícula cósmica rápida) lo
recupera pronto o atrapa otro. Pero a altas temperaturas, como en
el Sol, es muy diferente. Cuanto más caliente está
el gas, más rápido se mueven sus moléculas y
átomos, y a muy altas temperaturas las colisiones entre
estos átomos, moviéndose rapidamente, son
suficientemente violentas para liberar los electrones. En la
atmósfera solar, una gran parte de los átomos
están permanentemente ionizados por estas colisiones y el
gas se comporta como un plasma.
A diferencia de los gases fríos
(p.e., el aire a temperatura ambiente), los plasmas conducen la
electricidad y son fuertemente influidos por los campos
magnéticos. La lámpara flúorescente, muy
usada en el hogar y en el trabajo, contiene plasma (su componente
principal es vapor de mercurio) que calienta y agita la
electricidad, mediante la línea de fuerza a la que
está conectada la lámpara. La línea,
positivo eléctricamente un extremo y negativo otro, causa
que los iones positivos se aceleren hacia el extremo negativo, y
que los electrones negativos vayan hacia el extremo positivo. Las
partículas aceleradas ganan energía, colisionan con
los átomos, expulsan electrones adicionales y mantienen el
plasma, aunque se recombinen partículas. Las colisiones
también hacen que los átomos emitan luz y esta
forma de luz es más eficiente que las lámparas
tradicionales. Los letreros de neón y las luces urbanas
funcionan por un principio similar y también se usa (ro)n
en electrónica.
Importante plasma en la naturaleza es la
ionosfera, que está a 70-80 km por encima de la tierra).
Aquí los electrones son expulsados de los átomos
por la luz solar de corta longitud de onda, desde la ultravioleta
hasta los rayos X.
CARACTERISTICAS DE LOS ESTADOS DE
LA MATERIA
Estado de | Sólido | Líquido | Gas | |
Volumen | Definido | Definido | Indefinido | |
Forma | Definida | Indefinida | Indefinida | |
Compresibilidad | Incompresible | Incompresible | Compresible | |
Atracción entre | Intensa | Moderada | Despreciable | |
Cambios de estados de
la materia

Un cambio es "la transformación o
modificación que sufre la materia ante un factor externo,
como la temperatura"; estas modificaciones o cambios que puede
sufrir la materia son de 3 tipos: físico, químico y
nuclear.

Un cambio físico es cuando una
sustancia cambia o pasa de un estado a otro, sin perder sus
propiedades, cuando se aumenta o disminuye la temperatura. Cuando
dos o más sustancias se unen y luego dan origen a una o
más sustancias nuevas, entonces las primeras
sustancias han sufrido un cambio químico; el
núcleo de los átomos de ciertas sustancias puede
romperse y sufrir alteraciones conocidas como cambio
nuclear. La temperatura juega un papel importante en estos
cambios.
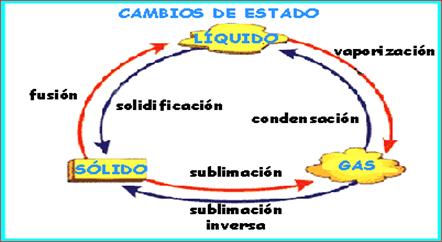
Cambios físicos. Los
cambios físicos se refieren a que la materia puede pasar
del estado sólido a líquido, de líquido a
gas y viceversa. Para que ello ocurra es necesario que la
temperatura sea aumentada o reducida, respectivamente.
El agua es una de las pocas sustancias que
se encuentra en los 3 estados de la materia (solido,
líquido y gaseoso), y que puede experimentar los seis (6)
cambios físicos que a continuación se
detallan.
– Fusión. Es el cambio que
una sustancia sufre cuando pasa de estado sólido a
líquido.
Para que esto suceda debe incrementarse la
temperatura a la sustancia en cuestión. Por ejemplo, el
hielo es agua en estado sólido que cuando se le aumenta la
temperatura se convierte o pasa a estado
líquido.
– Solidificación. Es el
proceso inverso de la fusión, o sea, cuando una sustancia
pasa de estado líquido a sólido. Aquí la
temperatura debe disminuirse. Por ejemplo, cuando el agua en esta
liquido se coloca dentro de un congelador luego se convierte en
hielo, que es estado sólido.
– Vaporización o
evaporación. Es cuando una sustancia liquida pasa o
se convierte a gas, por acción de la alta
temperatura.
Los estanques y el mar están
formados por agua líquida, mucha de la cual se evapora o
bien se convierte en gas por acción de los rayos solares,
formándose así las nubes No es necesario que el
líquido hierva para que la vaporización suceda,como
es el caso del agua de mar y de los estanques, los cuales no
hierven pero si sufren evaporación.
La vaporización solo se lleva a cabo
sobre la superficie de los líquidos y a cualquier
temperatura que no sea fría, mientras que la
ebullición sucede en todas las partes del líquido y
solo a temperaturas muy altas.
– Condensación. Es el
proceso inverso de la vaporización, es decir, es cuando la
sustancia pasa de gas a líquido. Este
cambio es posible si se disminuye la temperatura.
Un ejemplo claro es el rocío de la
mañana: la niebla es vapor de agua helada (gas), que
cuando entra en contacto con la superficie de hierbas, arboles,
carros, etc. se convierte en agua liquida llamada rocío,
por lo cual los objetos amanecen mojados.
La condensación es importante en el
proceso de destilación y en el funcionamiento de las
máquinas de vapor, donde el vapor de agua utilizado se
vuelve a convertir en agua en un aparato llamado
condensador.
– Sublimación. Es cuando la
sustancia puede pasar directamente del estado
sólido a gas. Este cambio necesita de
temperatura muy alta.
Un ejemplo es el alcanfor o bolita de
naftalina que se encuentra en estado sólido, pero que al
estar al descubierto rápidamente comienza a evaporarse o
emitir gases.
-Deposición o sublimación
inversa. Se refiere al cambio que sufre una sustancia del
estado de gas a sólido, en forma directa,
es decir, sin pasar por el estado líquido; en este caso
debe disminuirse mucho la temperatura. En muchos lugares de la
tierra el vapor de agua (nubes) y la neblina se enfrían
tanto que se convierten en granizo, el cual es
sólido.
Clasificación
de la materia
Toda la materia de nuestro planeta se puede
clasificar utili zando un solo método o criterio a la vez
de los cuatro siguientes:
– Según su aspecto.
– Según su composición. Es
decir, según su naturaleza y cantidad de
materia.
– Según su conductividad
eléctrica.
– Según su estado
físico.
Para los dos últimos métodos,
el calor es el principal factor para clasificar a la materia.
Como vimos anteriormente, el calor provoca que la materia cambie
de un estado a otro; así mis – mo, cuando la temperatura
de los materiales aumenta entonces estos se dilatan, es decir, au
-mentan de tamaño. Además, cuando dos materiales
con diferente temperatura entran en con- tacto tienden entonces a
quedarse con la misma temperatura, conduciendo el calor entre
ellos; aquellos materiales que pasan o trasladan
fácilmente el calor se llaman buenos conductores,como
algunos metales.
– Según su aspecto.
Según este criterio, toda la materia se clasifica en
homogénea y hetero -génea. La materia
homogénea es la que presenta un aspecto uniforme, en la
cual no se pueden distinguir a simple vista sus componentes; lo
contrario sucede con la materia heterogénea, en la cual si
se puede distinguir algunos o todos sus componentes (varias
partes).

Materia homogénea. Al
observar cierta clase de cuerpos, objetos y sustancias pareciera
que es tán formados por un solo tipo de materia o
sustancia; sin embargo, al realizarle un análisis
físico resultara que dichos objetos están formados
por dos o más sustancias diferentes. Por ejem – plo,
cuando se mezcla agua con alcohol resulta una solución que
pareciera estar formada por una sola sustancia, es decir, la
solución tiene un solo aspecto, una sola fase, en donde no
se puede distinguir el agua del alcohol. Este tipo de materia
recibe el nombre de materia homogénea, como por ejemplo:
vinagre, acero, orina, sudor, agua salada, agua azucarada, el
aire, sangre,etc.
Materia heterogénea. La
materia heterogénea es aquella en la que se puede
distinguir las sus- tancias que la componen. Este tipo de materia
presenta dos o más fases, que corresponden a aquellas
sustancias que la forman; dicho de otro modo, la materia
heterogénea presenta dos o más aspectos. Por
ejemplo, la mezcla de albañil es materia homogénea,
pues en ella se puede apreciar o distinguir el agua, el cemento
gris y la arena que la forman, aun cuando estas sus -tancias ya
estén revueltas o mezcladas.
– Según su
composición. La materia también se puede
clasificar en sustancias puras y mezclas.

Las sustancias puras a su vez se dividen en
sustancias simples y sustancias compuestas. A las sustancias
simples se les conoce como elementos químicos, como el
carbono, oxigeno, hierro, etc.; y las sustancias compuestas se
les denomina así por estar formadas o compuestas por dos o
más elementos químicos, tal como el agua, que
está compuesta por hidrogeno y oxígeno.
Los elementos químicos son
sustancias simples, pues están formadas por un solo tipo o
clase de átomos y, que por lo tanto, no pueden
descomponerse en otras sustancias más sencillas por los
medios químicos ordinarios.
Los compuestos químicos resultan de
la combinación química, o reacción
química, de dos o más sustancias simples,por lo que
están formadas por dos o más tipos de
átomos, y pueden descomponerse en distintas sustancias por
procedimientos químicos.
Una mezcla resulta de la combinación
física (no química) de dos o más sustancias,
cada una de las cuales conserva su identidad y propiedades
específicas.En una mezcla se pueden separar los
componentes por procedimientos físicos sencillos. Las
mezclas a su vez se dividen en homo géneas y
heterogéneas. A las primeras se les conoce como soluciones
químicas.
Son ejemplos de mezclas homogéneas
el agua salada, agua azucarada, aire, alcohol diluido, etc.; son
ejemplos de mezclas heterogéneas la mezcla de
albañil, agua con arena, etc.
– Según su conductividad
eléctrica. Cierta clase de materia tiene la
propiedad de conducir el calor y la energía, por lo cual
recibe el nombre de materia conductora, tal como el cobre con el
cual se fabrican hilos o alambres para conducir la energía
eléctrica. En base a esta propiedad, toda la materia se
puede clasificar en conductora y no-conductora. Ejemplos de
materiales conduc- tores son: aluminio, zinc, hierro, grafito y
silicio.

– Según su estado
físico. Dependiendo como se presente en la
naturaleza y ante nuestros ojos, la materia se clasifica en:
solida, liquida, gaseosa y plasma, estados que ya fueron
explicados. Sin embargo, se han descubierto otros estados
físicos de la materia, como el condensado de
Bose-Einstein, los cuales no son de interés para el
presente texto.

Bibliografía
1. http://es.wikipedia.org/wiki/
24-julio-2008; 1 pm
2.
http://personal1.iddeo.es/romeroa/materia/solucionmasa.htm
3.
http/www.juntadeandalucia.es/averroes/recursosinformaticos/
4.
http//newton.cnice.mec.es/1eso/materia
5. http//www.
si-educa.net/básico/
6.www.puntodeandalucia.es/averroes/recursos_informaticos/concurso1999/acce
sit3/propiedadesmateria.htm
7. Fundamentos de Ciencias Naturales.
Universidad Pedagógica Nacional ¨Francisco
Morazán. Fondo Editorial UPNFM. Tegucigalpa, Honduras.
2001.
8.
www.rena.edu.ve/terceraetapa/quimica/ClasMaterial.htm/
9.
http://es.wikipedia.org/wiki/Estado_de_agregaci%C3%B3n_de_la_materia
10. www.landsil.com/contacto.htm
11. http://images.google.cl/
12.
http://www.unidata.ucar.edu/staff/blynds/tmp.html 11-oct-2008, 12
pm. (Inglés)
13. Wikipedia Español – La
enciclopedia libre. Ver más en Wikipedia.org…
Autor:
Jorge Marconi
