- Introducción
- Definición
- Recuerdo Anatómico
- Clasificación de los
TRP - Algoritmo diagnóstico de los
TRP - Anatomía
Patológica - Diagnóstico
- Tratamiento
- Pronóstico
- Casuística
- Conclusiones
- Bibliografía
- Anexos
Introducción
Los tumores retroperitoneales primitivos (TRP)
constituyen una entidad infrecuente dentro de la patología
tumoral (0,07 – 0,2% de todas las neoplasias del
organismo).¹
En nuestro medio las publicaciones sobre el tema son
limitadas y las mismas se basan en series con bajos
números de casos.
En el espacio retroperitoneal se desarrollan una gran
variedad de tumoraciones primitivas y secundarias que se originan
a partir de diferentes órganos y tejidos, por lo cual
delimitaremos el tema al desarrollo de los TRP del
adulto.
Los TRP son de diagnóstico tardío y
mayormente malignos.
La recidiva locorregional es el principal factor
pronóstico, es la principal causa de muerte y constituye
un gran desafío para el equipo tratante.
El objetivo del presente trabajo es actualizar y
analizar aspectos vinculados con el diagnóstico
imagenológico, avances en la biología molecular,
inmunohistoquímica y las opciones terapéuticas
actuales.
Definición
Se definen por su carácter de neoplasias
primitivas del espacio retroperitoneal, excluyendo aquellas
derivados de las vísceras de la región y los
tumores que en su crecimiento lo comprometen
secundariamente.
Por su origen embriológico son aquellos tumores
derivados del mesodermo posterior y del neuroectodermo,
excluyendo las vísceras de origen endodérmico que
ocuparon secundariamente el espacio retroperitoneal.
Por consecuencia quedan excluidos de esta
clasificación los tumores primarios de la aorta abdominal,
la vena cava inferior, sistema genitourinario, glándulas
suprarrenales, páncreas, duodeno, colon y estructuras del
sistema nervioso autónomo; así como
metástasis en órganos y/o tejidos de la
región.
Resumiendo, los criterios que definen estos tumores
son:
asentar en el espacio retroperitoneal y
ser histológicamente primitivos.
Recuerdo
Anatómico
Previo al desarrollo del tema es necesario realizar una
reseña anatómica del espacio retroperitoneal,
jerarquizando sus diferentes compartimentos.
El espacio retroperitoneal es una región de gran
complejidad anatómica, en virtud de las diversas
estructuras allí alojadas, los numerosos e importantes
pedículos vasculares, nerviosos y linfáticos que lo
atraviesan.
El retroperitoneo se define como aquel sector de la
cavidad abdominal comprendido entre el peritoneo parietal
posterior definitivo ventralmente, la fascia transversalis con la
pared posterior del abdomen dorsalmente, el músculo
diafragma arriba y la pelvis abajo con lo cual comunica
libremente a través del estrecho superior de la
pelvis.
La arquitectura de dichos compartimentos y la
disposición de las distintas láminas y fascias
determinan la posible extensión, migración y/o
caminos que puedan tomar los numerosos procesos
patológicos de la región, especialmente las
neoplasias.
Concepción clásica
Descripciones clásicas dividen al espacio
retroperitoneal en tres grandes sectores:
– retroperitoneo medio, vía de tránsito de
los grandes vasos que descienden a la pelvis o ascienden al
torax, acompañados por el eje linfático
infradiafragmatico y por la cadena nerviosa lumbar paravertebral
perteneciente al sector periférico del sistema nervioso
simpático.
– retroperitoneo lateral; a ambos lados del precedente,
región preponderantemente visceral conteniendo
órganos del aparato urinario y del sistema endocrino.
2
Concepción moderna
La rápida evolución de los estudios
imagenológicos sobre todo a partir del desarrollo de la
tomografía computada (TC) puso en evidencia cierta
discordancia entre las descripciones clásicas puramente
anatómicas y hechos observados en determinadas situaciones
patológicas, en donde la distribución de
líquidos y colecciones no se encontraban.2
Por ello a partir de los trabajos pioneros de Meyers3,
en la década de los de los 60 y 70 donde establece el
concepto de anatomía compartimental de la región.
Actualmente se considera al retroperitoneo como una región
formada por distintos compartimentos o espacios delimitados por
planos fasciales bien delimitados en donde la fascia perirrenal
es el elemento fundamental en la división
topográfica del mismo. Figura 1.

Figura 1.
Espacios del retroperitoneo
Los espacios del retroperitoneo son denominados por
Hureau4 como espacios interparietoperitoneales posteriores. Los
mismos están centrados por la logia renal en su totalidad,
prolongándose por arriba y por debajo de esta
celda.
Son consideradas verdaderas logias adipo-viscerales
retroperitoneales, situándose entre las fascias de
acolamiento visceral por delante (retro-duodeno-cefalopancreatica
de Treitz. Retro-corporo pancreatica de Told, retro-colonicas
derecha e izquierda de Told), y fascia parietal por
detrás. Comprendiendo en su conjunto elementos vasculares,
urinarios y endocrinos primitivamente
retroperitoneales.
En este amplio espacio, el tejido celuloadiposo se
dispone alrededor de estructuras, ocupando los espacios
determinados por el comportamiento de la llamada fascia renal y
latero-conal de
Meyers 3.
En las concepciones actuales, establecida por Hureau4 en
1991 basados en precisas descripciones imagenológicas, los
limites y divisiones de esta vasta región son un poco
diferente a los descritos en textos clásicos de
anatomía.
Esta definición conceptualiza la real continuidad
de los espacios lo que da una visión distinta de la
compleja región abdominal posterior. Figura 2.
Son claras las razones que sustentan dicha
división y entre ellas las de orden embriológico,
proporcionando las bases necesarias para el entendimiento de la
anatomía topográfica de esta
región.

Figura 2. TC abdomen.
Se observa la distribución
anatómica de los espacios interfasciales.
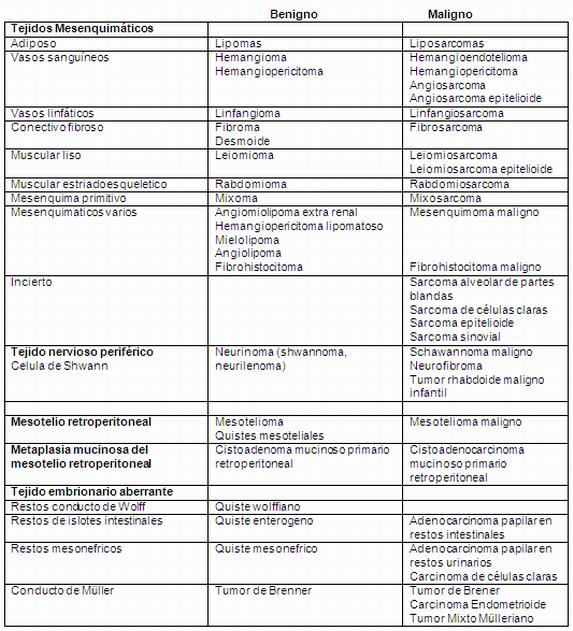
Clasificación de los
TRP
Clásicamente las tumoraciones de partes blandas
se clasificaron de acuerdo a la embriogénesis,
histogénesis y su comportamiento biológico. La
misma fue descrita por Ackermann5 en 1954.
Cuadro 1.
Los Tumores quísticos retroperitoneales
según Lahey6 se clasifican de acuerdo al origen. Cuadro
2.

Cuadro 2. TRP
quísticos.
La nueva clasificación (2002) de la
Organización Mundial de la Salud (OMS) de tumores de
partes blandas incorpora detalles clínicos,
histológicos, genéticos y
biológicos.7
En los últimos 15 años se ha producido una
explosión en la citogenética y en la
genética molecular lo cual ha determinado cambios en la
clasificación.8
De acuerdo a su comportamiento biológico se
clasifican en cuatro categorías como se describen a
continuación:

El desarrollo completo de la
clasificación con sus categorías se detallan en
anexo 1.
Algoritmo
diagnóstico de los TRP
El siguiente esquema resume el algoritmo diagnostico a
tener en cuenta frente a toda tumoración que se
topografía en el espacio retroperitoneal.

** Las tumoraciones RP neoplásicas
secundarias se detallan en la siguiente tabla:

Anatomía
Patológica
A pesar de derivar de tipos celulares diferentes, las
variantes histológicas conocidas como sarcomas se agrupan
por su similar actividad biológica.
Estos subtipos de sarcomas comparten la tendencia al
comportamiento agresivo local, crecimiento lento, no invasivo y
raramente metastasiantes y plantean un gran desafío
diagnostico para el patólogo.
Avances recientes en la inmunohistoquímica (IHQ),
microscopia electrónica (ME) y citogenética
molecular han logrado criterios precisos y reproducibles en la
identificación los diferentes subtipos
histológicos.
En la tabla 1 se observan las variedades
histológicas más frecuentes que se
topografían en el espacio retroperitoneal.9

HMF: histocitoma fibroso maligno, MPNST:
tumor maligno de la vaina nervio periférico
Tabla 1. Subtipos histológicos de
los sarcomas retroperitoneales reportados desde 1991.
La revisión en la literatura de los
últimos 30 años demuestra cambios porcentuales en
las diferentes variedades histológicas.
El liposarcoma continúa sienádo la
variedad más frecuente (33%) seguido del leiomiosarcoma
(24%).
Como se observa en la tabla 1, las variaciones
evolutivas en el tiempo en los porcentajes de los subtipos
histológicos se deben a cambios permanentes en las
definiciones basados en el uso de técnicas de
identificación.
El histocitoma fibroso maligno (HMF) constituye un claro
ejemplo de lo mencionado previamente, ya que la aplicación
de IHQ, ME, hibridación genómica comparativa y la
fluorescencia de hibridación in situ (CGH) permite
reclasificarlo en otras estirpes histológicas como
liposarcoma y leiomiosarcoma.9
Los tumores pobremente diferenciados complican aun
más la clasificación ya que comparten
características histológicas comunes con varios
subtipos. Dependiendo del tipo así como el número
de técnicas de identificación aplicadas al
reconocimiento histológico permiten disminuir el
porcentaje de tumores no clasificables, siendo el mayor
porcentaje de los mismos los sarcomas indiferenciados.
El grado histopatológico es un factor de enorme
valor en cuanto al tratamiento y pronostico. Los
parámetros que se utilizan para valorar el grado tumoral
son: (Tabla 2).10
– diferenciación |
|
– estroma |
– vascularización |
– necrosis |
– numero de mitosis |
Tabla 2.
Parámetros que valoran el grado
tumoral
La aplicación de los
parámetros mencionados previamente permite clasificar a
los sarcomas en bajo y alto grado. Tabla 3
Bajo grado | Alto grado |
Buena | Pobre |
Hipocelularidad | Hipercelularidad |
Mucho estroma | Minimo estroma |
Hipovascular | Hipervascular |
Minima necrosis | Mucha necrosis |
Menos de 5 mitosis por 10 campos gran | Mas de 5 mitosis por 10 campos gran |
Tabla 3.
Describiremos brevemente los subtipos
histológicos más frecuentes y sus
características.
Tejido Adiposo
lipoma y liposarcoma.
El lipoma es la neoplasia benigna mesenquimática
mas frecuente de la economía.
La topografía retroperitoneal es poco frecuente.
Son predominantemente puros aunque en raras ocasiones pueden
contener elementos teratomatosos maduros, combinando la presencia
de un hamartoma, lipoma y un teratoma.
En ocasiones puede presentarse de carácter mixto
asociándose tejido vascular y muscular liso
(angiomiolipoma), que habitualmente es de ubicación renal
aunque puede poseer localización retroperitoneal como
posible ubicación extrarrenal. Pueden adquirir gran
volumen en su lento crecimiento y adaptación en un area
silente como el retroperitoneo.
Liposarcoma, la topografía retroperitoneal es la
de peor pronóstico.
Según la clasificación de la OMS los
liposarcomas se clasifican en los siguientes subtipos: bien
diferenciado / desdiferenciado, mixoide / de células
redondas y pleomórfico.11
Desde el punto de vista macroscópico, el lipoma
es semejante al liposarcoma bien diferenciado (uno de los dos
tipos de liposarcoma de bajo grado de malignidad) del cual
difiere a nivel histológico por los nucleos
atípicos en el sarcoma, conservando semejante
histoarquitectura con el lipoma. El otro tipo de liposarcoma de
bajo grado (liposarcoma mixoide), difiere a nivel
macroscópico por el aspecto mixoide difuso que posee,
asociado a nivel histológico por una rica
vascularización arborizada, además de atipias
nucleares.
Los otros tipos de liposarcomas son de alto grado, uno
de células redondas pequeñas, de difícil
diagnostico con otros sarcomas y linfomas y el liposarcoma
pleomorfico con figuras gigantocelulares atípicas
frecuentes, identificándose por la diferenciación
lipoblastica con citoplasma conteniendo
lípidos.
En ocasiones, se presentan en el mismo tumor mas de un
tipo histológico de liposarcoma, coexistiendo uno de bajo
grado en la periferia del tumor y de alto grado en el
centro.
La recidiva locoregional es frecuente y se debe a
nódulos satélites cercanos a la masa o al
crecimiento por planos fasciales.12
Microscópicamente los liposarcomas bien
diferenciados consisten en un fondo de adipocitos que contienen
dispersos lipoblastos cada uno con un nucleo rodeado de grandes
vacuolas intracitoplasmaticas. Figura 3.

Figura 3. Liposarcoma
desdiferenciado.
Se observan áreas fusocelulares
con patrón fasciculado y vorticular. Núcleos
polilobulados, pleomórficos y zonas de adipocitos
irregulares entremezclados con células fusiformes y
lipoblastos.
El liposarcoma bien diferenciado ha cambiado su
terminología y paso ha llamarse tumor lipomatoso
atípico que refleja su naturaleza benigna, salvo cuando
estos tumores surgen del retroperitoneo y mediastino. Esto se
debe a su importante mortalidad relacionado a la recurrencia
local.13
Tejido muscular liso
leiomiosarcoma
El leiomiosarcoma es un tumor maligno originado en
células del musculo liso. El 75 % se presentan en el
retroperitoneo o cavidad abdominal. Se caracterizan por su
diseminación por planos tisulares e invasión de
estructuras adyacentes incluyendo grandes vasos.
Macroscópicamente son masas nodulares bien delimitadas que
contienen pseudocapsula con diferentes regiones de hemorragia,
necrosis y cambios quísticos.
Microscópicamente estos tumores están
formados por células cónicas, en forma de huso,
alargadas, nucleos romos y citoplasma brillante
eosinofílico.
Se consideran uno de los subtipos retroperitoneales mas
agresivos.
Tumores fibrohistocíticos
histocitoma fibroso maligno (HFM)
HFM son tumores multinodulares, pobremente encapsulados,
con areas de hemorragia y necrosis. Histológicamente se
caracterizan por su amplio pleomorfismo, la presencia de
histocitos y células fibroblásticas. Se han
definido diversas variedades histológicas: fibroso de
células gigantes, inflamatorio y mixoide. Entre los
patrones de crecimiento se reconocen el estoriforme o en rueda de
carro, fascicular y pleomórfico.
Tejido Fibroso
fibrosarcomas
Representan el 1-5% de los sarcomas. Tumor relacionado
con la secreción de insulina lo cual provoca hipoglicemia
pudiendo ser una de sus formas de presentación
clínica.
Neoplasia que se compone de células fusiformes,
dispuesta en fascículos en un diseño en espiga. Las
células tienen forma conica, nucleos oscuros,
nucléolo prominente y escaso citoplasma.
Tejido muscular esquelético
– rabdomiosarcoma
Son lesiones carnosas, de color gris palido y amarillo,
con areas de necrosis y hemorragia.
Insidiosamente invaden estructuras adyacentes de modo
que la resección debe ser con amplio margen. Las
resecciones marginales presentan alta incidencia de zonas
microscópicas comprometidas.
Los rabdomioblastos presentan un citoplasma intensamente
eosinofilo con estrias cruzadas visibles a nivel
citoplasmático que resultan de la alineación de
miofilamentos. El subtipo mas común es el embrionario, que
se caracteriza por alternancia de zonas de condensación
celular e hipocelularidad, con células flotando en la
sustancia mucoide. El subtipo botroide se caracteriza por su
parecido a un grupo de uvas, con aspecto macroscópico
característico. Se origina exclusivamente en superficies
tapizadas por mucosas como vejiga, vagina o
conjuntiva.
Presenta rasgo histológico característico,
una capa de cambium, que es una condensación
subepitelial de células tumorales llamado asi por su
semejanza con la capa de mas rápido crecimiento de un
árbol debajo de la corteza. El subtipo fusocelular se
asocia a un mejor pronostico.
El tipo alveolar es muy agresivo, caracterizado por
nidos de células separadas por septos fibrovasculares,
manifestando así su cierta semejanza a los alveolos
pulmonares.11
Tumores neurogénicos
Schwannoma incluye la variante celular, siendo el
tumor neurogenico mas frecuente a nivel
retroperitoneal.
Macroscopicamente son nódulos encapsulados que a
la sección presentan componente quístico y
hemorrágico. Microscópicamente se caracterizan por
las clásicas areas de Antony A, compuestas por
fascículos de células en espiga con nucleos en
palisada, hipocelular, areas Antony B mucoide, cuerpos de Verocay
e hialinización vascular.
Tumor maligno de la vaina nervio periférico
(MPNST)
Definido como el tumor mesenquimático maligno,
originado en células de la vaina nerviosa. Deben de
diferenciarse de tumores epineurales y de aquellos originados en
la vasculatura nerviosa.
Dos tercios de los casos se asocian a neurofibromas
preexistentes y la mitad en pacientes portadores de
neurofibromatosis tipo I.
Macroscópicamente se compone de un tejido
firme-nodular con extensa necrosis. Microscópicamente
presenta alta variedad morfológica (bien diferenciado –
anaplásico), la lesión prototípica celular
con arquitectura fascicular, células elongadas, nucleos
pleomórficos e hipercromáticos.
7- Estadificación
Para los sarcomas retroperitoneales se utiliza la
estadificación de la Unión Internacional Contra el
Cáncer (UICC, 2002)8, TNM sumado al grado tumoral. Esta
estadificación se aplica para todos los sarcomas, y a
nivel retroperitoneal tiene algunas particularidades. Tabla
4
Tabla 4. Sistema de estadificación de la UICC
para sarcomas de partes blandas
Grado (G) Gx G1 G2 G3 G4 | No puede evaluarse Bien diferenciado Moderadamente diferenciado Pobremente diferenciado Indiferenciado | Bajo grado Bajo grado Alto grado Alto grado | ||
Tumor primario (T) Tx T0 T1 T1a T1b T2 T2a T2b | No puede evaluarse Sin evidencia de tumor Tumor < 5cm superficial profundo Tumor > a 5cm superficial profundo | |||
Ganglios Regionales (N) Nx N0 N1 | No se pueden evaluar No comprometidos Comprometidos | |||
Metastasis a distancia (M) Mx M0 M1 | No evaluable Sin metastasis Metastasis a distancia | |||
Superficial / profundo, hace referencia en
relación a la fascia, en la topografía
retroperitoneal se consideran todos profundos.
Estadios
I | G1-2 | T1a, 1b, 2a, 2b | N0 | Mo | ||||
II | G3-4 | T1a, T1b, T2a | N0 | M0 | ||||
III | G3-4 | T2b | N0 | M0 | ||||
IV | G | T | N1 | M0 | ||||
G | T | N | M1 | |||||
El 90% presenta al diagnostico mas de 5cm y por la
topografía son todos profundos, por lo que el único
factor determinante entre estadio I y III es el grado de
diferenciación.9
Diagnóstico
a- Diagnostico
Imagenológico
La imagenología en TRP tiene como objetivos:
establecer el diagnostico, valorar la extensión lesional,
estadificación, planificar el tratamiento, guía
para biopsia y realizar el seguimiento.
Actualmente la tomografía computada (TC) y la
resonancia nuclear magnética (RNM) permiten realizar una
aproximación del tipo histológico.
Los estudios de rutina para el diagnostico de estos
tumores son la ecografía abdominal y la TC
incorporándose últimamente la RNM con ciertas
ventajas sobre la TC. 14
Ecografía abdominal:
Primera herramienta diagnostica, cuyo objetivo se resume
en la tabla 5:

abla 5. Rol de la ecografía en
tumores partes blandas.
La eficacia diagnostica de la ecografía abdominal
llega al 73% de los casos, brindándonos datos de su
contenido: solido / quístico, sus relaciones con
órganos vecinos (riñon, hígado, bazo,
páncreas), el doppler color aporta las relaciones
vasculares: aorta, cava, pedículo hepático, vasos
mesentéricos.15
El carácter quístico de una
tumoración no es sinónimo de benignidad, por el
contrario existen tumoraciones quísticas retroperitoneales
que son malignas como ha sucedido en nuestra serie
(cistoadenocarcinoma, sarcoma fusocelular) por lo que se debe de
valorar las características de la pared, papilas,
excrecencias y evolutividad.
En la tabla 6 se resumen las principales
características ecográficas de los
sarcomas:

Tabla 6. Características
ecográficas de los sarcomas de partes blandas.
Tomografía Computarizada (TC)
Estudio diagnostico que utiliza la radiografía de
rotación para generar imágenes de cortes
transversales.
Su ventaja es la rápida adquisición de
imágenes, reduciendo la necesidad de sedación. Los
avances tecnológicos recientes y la introducción
del multidetector de escáner de cortes finos ofrece la
capacidad de producir imágenes de alta resolución.
Estos conjuntos de datos permiten la reconstrucción de
imágenes multiplanares y tridimensionales. 16
Con el objetivo de evaluar la extensión lesional
se debe de realizar con contraste v/o e i/v, tórax,
abdomen y pelvis.
Es un estudio imprescindible para valorar
topografía, tamaño, relaciones, metástasis
pulmonares y hepáticas, permite evaluar la resecabilidad
así como el seguimiento. La valoración de la
excreción renal es de utilidad, ya que su ausencia
vinculada al tumor puede indicar compromiso del mismo e indicar
la nefrectomía.
En relación a la topografía, la figura 4
relaciona la tumoración con órganos del espacio
retroperitoneal. El desplazamiento de estructuras
anatómicas retroperitoneales es útil en este
sentido.17

Figura 4. A- signo del pico positivo: la
tumoración se origina del órgano.
B- signo del pico negativo: la
tumoración no surge del órgano, lo comprime y
desplaza.
C- signo del órgano fantasma, el
órgano de origen se vuelve indetectable debido a la gran
tumoración.
D- signo del órgano incorporado.
Indica que la tumoración se origina del mismo.
Figura 4-A, cuando una tumoración deforma los
bordes del órgano creando el signo del pico seguramente se
origina en el órgano. Por otra parte la ausencia de
alteración en los bordes del órgano indica que la
tumoración no se origina del mismo, figura 4-B y figura
5.
Cuando una gran tumoración se origina de un
órgano pequeño, muchas veces el órgano se
vuelve indetectable, conociéndose como signo del
órgano fantasma, figura 4-C.
Figura 4-D, cuando el órgano queda incorporado
parte o totalmente a la tumoración indica que se origina
del mismo.
El desplazamiento anterior del riñón,
glándulas suprarrenales, colon, páncreas y duodeno
sugieren el origen retroperitoneal de la tumoración.
Figura 5.

Figura 5. TC abdomen.
Se observa el desplazamiento anterior de
estructuras retroperitoneales por TPR.
Las características de la tumoración como
su contenido heterogéneo y la presencia de necrosis
sugieren su histología maligna, (figura 6). La presencia
de grasa macroscópica orienta al liposarcoma. La
calcificación u osificación en un liposarcoma se
considera como un factor de mal pronóstico ya que indica
desdiferenciación.
El compromiso tumoral de la luz de la vena cava inferior
es una característica del leiomiosarcoma.18
La mineralización tumoral orienta a condro u
osteosarcoma.

Figura 6, TC abdominopelvica.
Tumoración retroperitoneal solida, extensa, heterogenea,
caracteristicas de los sarcomas.
AngioTC: permite delimitar el tamaño del tumor,
la extensión y el origen así como el grado de
vascularización, características que ayudan a
definir su naturaleza.
Permite delinear la anatomía vascular cuando se
sospecha compromiso vascular. Kilkenny19 encuentra un 34% de
compromiso vascular en una serie de 63 pacientes portadores de
sarcomas retroperitoneales.
Las desventaja de la TC incluyen exposición a
radiación y la menor resolución del contraste que
la resonancia. Ademas el uso de contraste intravenoso presenta el
riesgo de reacciones alérgicas y de nefropatía.
16
Frente a tumoraciones quísticas son signos que
sugieren malignidad la presencia de tabiques, papilas y paredes
irregulares. (figura 7)

Figura 7. TC abdomen. Tumoración
retroperitoneal quística, pared irregular, tabiques,
papilas. Orientan a malignidad.
Resonancia nuclear magnética
(RNM)
Técnica que utiliza las propiedades
magnéticas de los núcleos de hidrógenos de
los tejidos del organismo, los mismos actúan como
pequeños imanes que giran al azar hasta que se someten a
un campo magnético aplicado externamente. El mismo genera
una imagen al recibir señales electromagnéticas que
se procesan en una computadora y se imprimen en una
pantalla.16
La ventaja sobre otras técnicas es la
resolución superior a otras modalidades
imagenológicas de corte transversal, lo cual resulta en la
visualización precisa de tejidos blandos.
Además permite la reconstrucción sagital,
coronal y transaxial.
Tiene como ventaja que no ioniza las moléculas
del organismo lo cual evita los efectos secundarios de la
radiación.
La desventaja de la RNM incluye tiempo de
realización prolongado, que puede requerir el uso de
sedación, asimismo existen numerosas contraindicaciones
basadas las alteraciones del campo magnético y la
implantación de estructuras metálicas implantadas
en el cuerpo. Las contraindicaciones absolutas incluyen la
presencia de marcapasos, desfibrilador cardiaco, aneurismas
clipados, neuroestimulador, dispositivos implantados para
infusión de medicamentos, implantes auditivos.
Pacientes con claustrofobia pueden no tolerar la
realización del procedimiento.
Como medio de contraste se utilizan el gadolinio (Gd) y
el manganeso (Mn), unidos a una sustancia quelante la cual
determina su farmacocinética y evita la
toxicidad.
Permite valorar las características de la
tumoración basados en la perfusión y aporta mejor
definición y resolución de estructuras vasculares
retroperitoneales, siendo útil en la planificación
de la cirugía.20
Sin embargo la especificidad es baja para la
caracterización de lesiones malignas: 25 –
48%.11
T1 y T2 son constantes de tiempo y se miden en
milisegundos (ms). Las imágenes en T1 tienen mejor SNR
(signal-to-noise ratio), por lo que son imágenes
morfológicas, presentando una mejor resolución
anatómica (tejido adiposo: hiperintenso en T1). Mientras
que las imágenes en T2, son mejores para valorar la
patología (agua: hiperintenso en T2). (figura 9 y
10).

Figura 9. RNM.
Tumoración solida
retroperitoneal
Imágenes en T1, mejor
caracterización de los órganos
sólidos.

Figura 10. RNM.
Tumoración quística
retroperitoneal
Imágenes en T2 se observa la
hiperintensidad de los líquidos.
De acuerdo a la perfusión del contraste en la
tumoración se puede sospechar su naturaleza. Se describen
4 patrones imagenológicos:
Sin realce: benigno
Con realce precoz y rápido lavado:
benignoRealce precoz y lavado lento: maligno
Realce tardío: benigno o tumores maligno con
componente mixoide.
Luego del tratamiento neoadyuvante la RNM se utiliza
para monitorizar la respuesta, basado en el porcentaje de
necrosis tumoral, factor importante que clasifica estos tumores
en respondedores de no respondedores.
Luego de la cirugía la RNM es la modalidad de
elección para valorar tumor residual, recidiva, fibrosis o
inflamación. Existen características particulares
que diferencian la inflamación benigna
postquirúrgica y la presencia de enfermedad residual o
recurrencia. De hecho solo cuando existe ausencia de señal
T2 se puede descartar la presencia de tumor residual en el lecho
quirúrgico. Pero la presencia de señal en T2 y la
captación de contraste puede observarse en el tumor y
cicatrices inmaduras.
Cabe señalar como inconveniente en pacientes con
enfermedad renal preexistente con el uso de contraste (Gd) es la
fibrosis sistémica nefrogénica.
Técnicas avanzadas como imágenes de
difusión ponderada y RNM con espectroscopia, pueden llegar
a ser fundamentales en la valoración de sarcomas. Estas
secuencias no requieren la administración de contraste i/v
y pueden aumentar la especificidad de la RNM convencional.
21
Con la espectroscopia la RNM puede valorar el
metabolismo tumoral, el cual se encuentra elevado en tumores
malignos.11
Tomografía por emisión de positrones
(PET scan)
Técnica de diagnóstico no invasivo que
genera imágenes fisiológicas por la
detección de la radiación emitida por positrones
administrados al paciente. Considerado el gold standard en
imágenes metabólicas, proporcionando
información sobre la extensión anatómica y
el comportamiento tumoral asi como orientar a desiciones
terapéuticas. 11
El indicador mas utilizado es el fluor-18
fluorodesoxiglucosa (FDG). Es un análogo a la glucosa que
se acumula en las células de forma proporcional a la tasa
del metabolismo de la glucosa. Proporciona un medio que permite
cuantificar el metabolismo de la glucosa como marcador
radioactivo en proporción a la tasa de
glucólisis.
El valor de captación estándar (SUV) es
una medida de cuantificación de la captación de FDG
(fluorodesoxiglucosa) (actividad metabólica) en una
región de interés. Debido a que el aumento del
metabolismo es una característica reconocida de
células malignas en comparación con células
normales, el PET-scan es una herramienta útil para la
evaluación de neoplasias malignas. Además las
neoplasias de alto grado tienen tasas aumentadas de
glucólisis y captación de FDG por lo tantos valores
mas altos de SUV que los de bajo grado y benignos. Varios
estudios sugieren que el PET-scan es una prueba confiable para
determinar la actividad biológica de un tumor así
como la predicción de necrosis tumoral luego del
tratamiento neoadyuvante. (figura 11).
La sensibilidad para la estadificación inicial
así como para valorar la recidiva que varía entre
el 66 – 96%. 11

Figura 11. PET scan coronal, imagen
peritoneal compatible con metástasis
Tomado de Cáncer Imaging 2005
18
b- Inmunohistoquímica
(IHQ)
La IHQ es una técnica que he revolucionado la
histopatología, siendo imprescindible en el proceso de
diagnóstico y clasificación de los tumores de
partes blandas.
Se trata de una técnica de inmunotinción
de antígenos presentes en células tumorales
utilizando anticuerpos marcados.
Técnica introducida desde 1980, desde entonces ha
producido un avance en 3 aspectos:
la disponibilidad de numerosos
anticuerposmejoras en las técnicas de
recuperación antigénicadisponibilidad de sistemas de detección
sensibles
Presenta 3 aplicaciones claras en tumores de partes
blandas: 22
identificar lesiones benignas poco frecuentes o
atípicascaracterizar tumores malignos no
mesenquimalesclasificar los sarcomas
1- identificación de lesiones
benignas poco frecuentes o atípicas
Las lesiones que puede identificar son:
PNST (tumor benigno de la vaina de nervio
periférico)Tumor fibroso solitario
Lesiones histocíticas
Mioepitelioma
Lesiones raras: paraganglioma, tumor glomus,
angiomiolipoma, lesiones miofibroblásticas.
2- Caracterizar tumores malignos no
mesenquimales
Cuando se diagnostica un tumor maligno se debe descartar
si se trata de un tumor no mesenquimal, como carcinoma
sarcomatoide, melanoma o linfoma.
Debe de diferenciarse con los tumores localizados en la
piel, mucosas, ganglios o en algunos órganos como
riñón, tiroides, pulmon y mama. Un claro ejemplo es
cuando existe una historia previa de tumor maligno no mesenquimal
y cuando se trata de un tumor que simula un fibrosarcoma,
hemangiopericitoma, o sarcoma sin clasificar.
La IHQ es muy útil para resolver estos
inconvenientes. La citoqueratina y EMA positivo marcan al
carcinoma sarcomatoide, proteína S100, HMB45 y melanA
marcan melanoma y CD45 linfoma.
Sin embargo la IHQ tiene sus limitaciones ya que algunos
carcinomas sarcomatoides son negativos para marcadores
epiteliales, mientras que algunos sarcomas son positivos para
tales marcadores. Puede ser difícil distinguir un
carcinoma sarcomatoide de un sarcoma sinovial desarrollado en
pulmon o riñon. Es en esta situación que la
biología molecular tal como RT-PCR, o hibridación
fluorescente in situ (FISH).22
3- Clasificación de sarcomas
Actualmente la IHQ juega un rol importante en la
identificación de la línea de diferenciación
de los sarcomas.
Sarcomas en los cuales la IHQ es determinante en el
diagnóstico como son rabdomiosarcoma, sarcoma epitelioide,
sarcoma de células claras, tumor desmoplásico de
células redondas y tumor estromal gastrointestinal.
También la IHQ es decisiva en el diagnostico de tumores
vasculares malignos así como sarcomas sinoviales. El
diagnostico de liposarcoma variedad mixoide, células
redondas y pleomórficos se realiza de acuerdo a las
características histológicas, ayudado por
positividad para proteína S100. La variedad mixoide y
células redondas presentan una traslocación
especifica t(12:16).
Para algunos sarcomas el perfil IHQ no es
específico o es inconstante por lo que los resultados
deben de interpretarse con cautela; corresponden a lo mencionado:
sarcoma de Ewing, leiomiosarcoma, tumores malignos de la vaina de
nervio periférico, dermatofibrosarcoma y
liposarcomas.
En la tabla 7 se observa la clasificación inicial
de los sarcomas usando los anticuerpos de primera línea
diagnóstica.
Página siguiente  |
