- Introducción
- Líquidos de
punción - Bioseguridad
- Protocolo de trabajo
- Cámaras de conteo de
glóbulos - Líquido
cefalorraquídeo - Líquido pleural
- Líquido ascítico o
peritoneal - Líquido sinovial o
articular - Análisis y
conclusiones - Resumen
- Referencias
bibliográficas
Introducción
Dentro de los materiales que se estudian en los
laboratorios de guardia, emergencia y urgencias se encuentran los
líquidos de punción (LPN).
Tanto por su labilidad como por la escasa oportunidad de
obtener segundas muestras como, así también,
producir resultados de importancia para el tratamiento
médico se requiere de pericia en su
análisis.
La pericia implica la normalización de un esquema
de trabajo y la definición de valores de referencia para
el laboratorio receptor del material.
La definición del esquema de trabajo queda
establecida en la norma ISO 15189 en el Manual de Procedimientos
(MP), donde se encuentran los Procedimientos Operativos
Específicos (POE), conjuntamente con Instructivos de
Trabajo (IT) que se adapten para los LPN (1).
El establecimiento de unos valores de normalidad
actualizados es algo de vital importancia para un laboratorio ya
que en el informe de resultados, cada valor, debe ir
acompañado del intervalo o rango de normalidad.
Se pueden establecer intervalos de referencias
biológicos basados en la bibliografía, pero
determinados parámetros varían según su
situación geográfica, condiciones ambientales y
otros factores, de ahí la necesidad de calcular y
establecer sus intervalos de referencia.
El Laboratorio de Emergencias (LE) por su propia
característica es sensible a la falta de un esquema de
trabajo dado los LPN
Objetivos
1 Crear un esquema de trabajo para los LPN
en el LE
2 Definir los valores de referencia de
normalidad de los LPN
Desarrollo
Líquidos
de punción
Existen numerosas patologías asociadas con las
alteraciones que se producen en los líquidos de derrame
(peritoneal, pleural, pericárdico y sinovial) y los
trasudativos como el LCR, denominados genéricamente como
LPN.
El estudio bioquímico de los LPN tiene por
objetivo contribuir con el diagnóstico de enfermedades que
se vinculan con los mismos, ya sea por afecciones en el
órgano primario, patologías adyacentes o
desbalances en el equilibrio hemodinámico.
Si bien existen parámetros básicos que se
incluyen en todo protocolo para el análisis de estos
materiales, la orientación que reciba el
bioquímico, a través del diagnóstico
presuntivo, lo conducirá a sugerir otras determinaciones,
que aportarán información útil al
médico. Esto es de fundamental importancia al momento de
procesar la muestra para su estudio bacteriológico ya que
orienta al microbiólogo en la elección de los
medios de cultivos adecuados para recuperar al o los posibles
agentes etiológicos infecciosos (2).
Bioseguridad
El protocolo de trabajo con líquidos corporales
exige el cumplimiento de las precauciones universales. Estos
líquidos pueden portar microorganismos patógenos
como la Neisseria meningitidis, Cryptococcus
neoformans, Mycobacterium tuberculosis, el virus de
la inmunodeficiencia humana (VIH) y los virus de la hepatitis,
entre otros.
Factores adicionales en la
transmisión:
– El tipo de fluido corporal (algunos contienen menos
agentes infecciosos)
– La ruta de entrada en el cuerpo (la entrada al
torrente circulatorio es más
eficiente)
– Presencia o ausencia de trauma tisular
– La dosis de fluido infectado recibido (volumen,
concentración, exposición
reiterada)
– Las condiciones del hospedador (influencia
genética, ambiental, infección
coexistente). Condiciones del paciente fuente (estado de
la infección).
Protocolo de
trabajo
El protocolo de trabajo de los líquidos
corporales está compuesto por:
a) examen macroscópico
b) examen citológico
c) análisis bioquímico (3).
Obtención del material
Las punciones que se realizan para la obtención
de los especímenes que aquí estamos tratando son
realizadas por los profesionales médicos.
Como regla general para todos los LPN, el material se
remitirá al laboratorio en un tubo estéril sin
anticoagulante para el estudio microbiológico y otra
porción en una jeringa con heparina estéril para el
análisis fisicoquímico y el recuento celular; la
excepción es el líquido cefalorraquídeo
(LCR), el cual se recogerá en tubos ausentes de
anticoagulantes.
El material en jeringa se colectará,
remitirá y tratará de la misma manera que se
procede para con aquella utilizada para el estudio de gases en
sangre. Se debe evitar el exceso de heparina y se
eliminará el aire atrapado en el interior de la jeringa
durante el proceso de extracción, posteriormente se
homogenizará por rotación suave y, en lo posible,
se enviará al laboratorio en forma inmediata.
Con el LPN se remitirá una muestra de sangre del
paciente con el fin de informar los índices de
significancia diagnóstica (2).
Recibo del material:
a) La realización de los estudios sobre el
material debe ser inmediata.
Verificar que la información del envase coincida
con la orden médica
b) Registrar las características
macroscópicas del material recibido,
turbidez, presencia de cóagulos, sangre, color,
entre otros.
Conteo citológico:
a) Traspasar una porción de líquido a un
tubo estéril para centrifugar.
La otra porción es colocada en la cámara
de Neubauer improved
(cámara de Fuchs – Rosenthal en el caso de LCR)
para el conteo citológico previa
dilución con líquido de Turk, que consta de una
solución de ácido acético al 3%
para lisar los hematíes con azul de metileno,
permitiendo la diferenciación entre los
neutrófilos y células
mononucleares.
b) Realizar el conteo citológico y reportar el
número de leucocitos y hematíes
encontrados en toda la cámara y expresarlos por
µl.
Centrifugar a 1000 rpm durante 10 minutos.
Frotis directo:
La otra porción del sedimento se utiliza para
realizar el frotis directo, colocando una gota del material entre
cubre y portaobjeto.
Dependiendo del tipo de líquido y lo indicado en
la orden médica, realizar frotis adicionales para la
tinción de Giemsa y la tinción con Tinta china.
Realizar el recuento diferencial de leucocitos, siendo el informe
de leucocitos en valor absoluto y el diferencial en porcentual
(3, 4).
Cámaras de
conteo de glóbulos
En los LPN se usa generalmente la cámara de
Neubauer improved.

Figura 1. Cámara de Neubauer
improved. Modificado de referencia 5.
La cuadrícula de recuento muestra 9 cuadrados
grandes, cada uno de 1 mm2. Los 4 cuadrados grandes (en las
esquinas) señalados con una "L" están
divididos, a su vez, en 16 cuadrados con aristas de 0,25 mm
y son los que se utilizan para el recuento de
leucocitos.
El cuadrado grande central está dividido en 25
cuadrados medianos con aristas de 0,2 mm estando cada cuadrado
mediano subdividido en 16 cuadrados pequeños con aristas
de 0,05 mm y una superficie de 0,0025 mm2. La profundidad de la
cámara es de 0,1 mm.
Los 5 cuadrados medianos señalados con una "E" se
utilizan para recuento de hematíes y de las
plaquetas.
Tiene especial relevancia que todos los cuadrados
medianos presentan en todos los lados líneas límite
triples. La línea central es la frontera con la que se
decide si las células de esta zona se deben contar o no
(6).
Para el recuento de células en LCR se usa la
cámara de Fuchs – Rosenthal. .
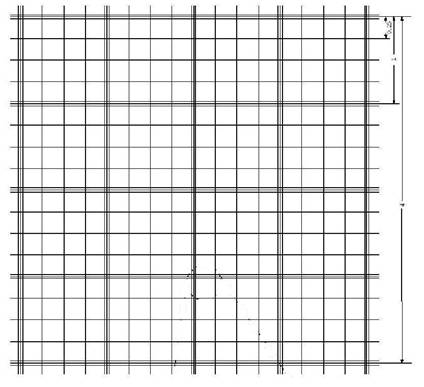
Figura 2. Cámara de Fuchs –
Rosenthal. Modificado de referencia 7.
La cuadrícula de recuento muestra 16 cuadrados
grandes, cada uno de 1 mm2. Cada cuadrado grande está
subdividido en 16 cuadrados pequeños con 0,25 mm de
aristas y una superficie de 0,0625 mm2. La profundidad de la
cámara es de 0,2 mm (6).
Cálculo de elementos presentes en la muestra
(6):
Fórmula:

Nota técnica:
En líquidos con presencia de coágulo, no
hacer el conteo citológico, porque el coágulo
aglutinó un número indeterminable de las
células. Reportar "Muestra con coágulo. No es
posible el conteo citológico ". Lo mismo si hay
piocitos.
Clasificación de los LPN
La clasificación se basa según su
origen:
a) líquido cefalorraquídeo
b) líquidos serosos
Entendemos como líquidos serosos a aquellos que
provienen de las cavidades pleural, pericárdica,
peritoneal y sinovial.
Por su baja incidencia, en esta monografía no se
desarrollará el protocolo para el líquido
pericárdico.
Tampoco se hará referencia a las prácticas
que no se realicen en un laboratorio de guardia, emergencia y
urgencias.
Líquido
cefalorraquídeo
3. 6. 1 Formación y
fisiología del líquido
cefalorraquídeo
El cerebro y la médula espinal
están recubiertos por las meninges, compuestas por tres
capas: la duramadre, la aracnoides y la piamadre. La capa externa
es la duramadre y la piamadre la mas interna (8, 9).
Entre las meninges existen tres espacios denominados
epidural, subudural y subaracnoideo. El espacio subdural se
sitúa entre la duramadre y la aracnoides y se pone de
manifiesto al producirse una acumulación patológica
de LCR. El espacio subaracnoideo se dispone entre la aracnoides y
la piamadre, conteniendo LCR (10).

Figura 3. Disposición general de
las meninges encefálicas. Modificado de referencia
10.
El LCR se encuentra en los ventrículos
cerebrales, donde se forma por secreción desde los plexos
coroideos (70%) que son estructuras situadas en los
ventrículos laterales, III y IV ventrículo; y a
partir de los capilares cerebrales (30%). El LCR fluye desde los
ventrículos laterales, y a través del agujero de
Monro, hacia el III ventrículo y, por el acueducto de
Silvio, hacia el IV ventrículo. Desde allí el LCR
alcanza el espacio subaracnoideo a través de las aberturas
situadas lateralmente (agujeros de Luschka) y por el agujero de
Magendie (11, 12, 13).
Dentro del espacio subaracnoideo el LCR se distribuye
hacia abajo por el canal vertebral y hacia arriba por la
convexidad cerebral (11).
El flujo del LCR es primero en sentido caudal y luego en
sentido cefálico (14).

Figura 4. Flujo del LCR a través
del cerebro y la médula espinal. Modificado de referencia
8.

Figura 5. Dibujo descriptivo de diversas
áreas del cerebro. Modificado de referencia 13.
En el ser humano hay unos 150 ml de LCR de los cuales 30
ml se encuentran situados en los ventrículos cerebrales y
los 120 ml restantes en el espacio subaracnoideo (9).
La reabsorción del LCR se realiza en las
vellosidades subaracnoideas. La formación y
reabsorción del LCR es de unos 500 ml/día. La
meningitis y la hemorragia subaracnoidea (HSA) pueden obstruir
las vellosidades subaracnoideas, disminuyendo la
reabsorción y produciendo hidrocefalia (11,
13).
El volumen de LCR varia de acuerdo a la edad:
· Recién Nacido:
40 a 60 ml.
· Niño: 60 a 100
ml.
· Adolescente: 80 a 120
ml.
· Adulto: 140 + – 30
ml.
Ventrículos laterales: 30 ml.
Ventrículos III y IV: 10 ml.
Espacios subaracnoideos cerebrales y cisternas: 25
ml.
Espacio subaracnoideo espinal: 75 ml (12).
Las funciones del LCR son:
a) soporte y protección del sistema nervioso
central (SNC)
b) recogida de productos de desecho
c) circulación de nutrientes (9, 15).
El LCR está aislado de la circulación por
dos barreras:
– La barrera hematoencefálica (BHE) que impide la
entrada de compuestos al SNC, como prácticamente las
proteínas.
– La barrera hematocefalorraquídea que impide la
entrada de compuestos al
LCR (11).
La siguiente figura indica las relaciones funcionales
entre ambas barreras:

Figura 6. Relaciones funcionales entre
ambas barreras. Las flechas indican el sentido del flujo de LCR.
Modificado de referencia 11.
3. 6. 2 Obtención de la muestra
Se obtiene el LCR por punción lumbar entre las
vértebras L4 – L5. Debe descartarse la existencia de
presión intracraneal elevada. La presión normal del
LCR es en adultos de 90 a 180 mm. de Hg. y en niños es de
10 a 100 mm. de Hg; con presiones normales pueden extraerse hasta
20 ml, pero si la presión inicial excede los 200 mm. de Hg
no deben extraerse más de 2 ml.
Se dispensa en tres alícuotas:
tubo 1:estudios bioquímicos e
inmunológicos
tubo 2: examen microbiológico.
tubo 3: recuento de leucocitos con conteo
diferencial.
Siempre es necesario comparar los valores del LCR con
los de una muestra de sangre, y ambas muestras han de obtenerse a
la vez (9, 15, 16).
3. 6. 3 Examen macroscópico del LCR
Aspecto.
El aspecto normal es límpido, no precipita ni
coagula con una viscosidad similar a la del agua (por lo que se
compara con el agua del cristal de roca).
Alteraciones:
Turbio (opalescente) es el aspecto que toma el
LCR cuando posee aumento de su contenido en leucocitos, a
predominio de polimorfonucleares; presencia de gérmenes
(>100000 unidades formadoras de colonia (UFC); más de
400 hematíes/µl o por aumento de
proteínas.
Varía desde levemente turbio a purulento. Se lo
observa en presencia de meningitis bacteriana y en los abscesos
tras su rotura. Rara vez las meningitis virales pueden provocar
un LCR ligeramente turbio.
Coágulos por fibrinógeno:
punción traumática (más de 200 x103
hematíes/µl) o meningitis purulenta. No aparece en
HSA.
Viscosidad aumentada: Meningitis
criptococcica.
Glóbulos de grasa de diversos
tamaños por embolismo graso en el cerebro.
Color.
Es incoloro como el agua de roca. Pueden presentarse las
siguientes si- tuaciones patologicas:
a) rojo (hemorrágico)
con todos sus matices de acuerdo a la etiología e
intensidad.
Puede ser de origen traumático: cuando la
punción rompió un vaso
sanguíneo en su paso al espacio subdural se la
confirma de varias maneras, por ejemplo con el
"signo de la escarapela": se explora
utilizando una gasa seca sobre la que se deja caer 2 – 3
gotas, observaremos un centro rojo homogéneo
rodeado de otra área mas clara o amarillenta
y finalmente, la mas periférica, mojada. Otra
manera de confirmarla es la "prueba de los tres tubos"
que consiste en juntar varias gotas en cada tubo
sucesivamente, el color rojo presente solo en el
primero o aclarándose progresivamente delata un
accidente técnico. El líquido
homogéneamente rojizo, en todos los tubos, se
debe a una hemorragia previa.
b) xantocrómico lo produce la
oxihemoglobina de la sangre derramada en el espacio
subaracnoideo y / o ventricular de varias horas.
También se lo puede observar en casos de
ictericia y de aumento de proteínas en el
LCR.
La xantocromía hace referencia a la
coloración rosada, anaranjada o amarillenta
del sobrenadante del LCR después de haberlo
centrifugado. La xantocromía aparece entre 2 y 4
horas después de
producirse una HSA (por rotura de un aneurisma o de una
fístula arteriovenosa).
Pasadas las 12 horas tras la hemorragia, aparece un
color amarillento entre los 4 y 8 días,
pudiendo estar presente hasta 4 semanas. El
sobrenadante de las muestras traumáticas es
transparente. La
xantocromía aparece cuando los hematíes se
han lisado. Pueden observarse xantocromías
producidas por:
• presencia de bilirrubina procedente del plasma en
el LCR debido a que su concentración es
superior a 5 mg/dl
• demora en la centrifugación de un LCR
hemático
• presencia de carotenoides por
hipercarotenemia
• presencia de melanina por un melanosarcoma en las
meninges
• contaminación con desinfectantes yodados
utilizados para la desinfección de la zona de
punción.
Signo de Froin: es un LCR xantocrómico
que en contacto con el aire coagula (por aumento de
la concentración proteica) es frecuente
observarlo cuando se extrae LCR distal a un bloqueo
completo de la
circulación del líquido a nivel
espinal.
c) verdoso: aparece en situaciones de
aumento de bilirrubina y en presencia de una elevada
cantidad de leucocitos polimorfonucleares
neutrófilos (debido al color verde de la
mieloperoxidasa)
d) negro: sugiere la presencia de
metástasis de un melanoma
e) transparente: se da en varias
meningoencefalitis con moderada elevación de
leucocitos (10 – 100/µl), moderada elevación
de proteínas (hasta 100mg/dl), glucosa normal
o disminuida (9, 14, 15,
17, 18, 19).

Figura 7. Tubos con LCR. De izquierda a
derecha: normal, xantocrómico, con hemólisis,
turbio. Modificado de referencia 8.
Resumiendo:
Turbidez | Color |
Cristalino o transparente | Incoloro (agua de roca) |
Turbio | Xantocrómico |
Purulento | Rojizo (hemático) |
Lechoso | Hemorrágico |
Tabla 1. Examen macroscópico del
LCR. Modificado de referencia 9.
Determinaciones | Punción traumática | Hemorragia subaracnoidea |
Aspecto tubo 1, 2, 3 | Desigual | Igual |
Coágulos | A menudo | No se observa |
Sobrenadante | Incoloro | Xantocrómico |
Espectrofotometría entre 370 y 530 | Negativo | Pico a 415 (oxihb). Pico a 450 – 460 (Bb). |
Tabla 2. Diferencias entre HSA y
punción traumática. Modificado de
referencia
15.
3. 6. 4 Examen citológico
El estudio de las células debe realizarse antes
de dos horas, para evitar que se produzca la lisis de las
mismas.
El uso de los analizadores hematológicos para el
análisis de LCR es una alternativa al método manual
para descartar líquidos patológicos. En la zona de
decisión clínica (10 leucocitos/µl) el
aparato puede sobrevalorar el número de células.
Por ello se propone la realización manual cuando el
recuento automático esté entre 8 y 20
leucocitos/µl.
La citocentrifugación es un método para el
recuento diferencial de leuco- citos, que nos permitirá
obtener una concentración de las células sin
alterar su morfología para su posterior
identificación con la tinción de Giemsa: en un
portaobjetos se dispensa con una pipeta pasteur una gota de LCR,
haciéndole un frotis. Se fija con metanol cinco minutos y
luego se agrega solución de Giemsa.
Se espera diez minutos y se lava bajo el chorro de la
canilla. Se deja secar.
En el caso de no disponer de citocentrífuga se
puede centrifugar la muestra con una centrífuga a 500 rpm
durante 5 minutos, separando el sobrenadante y realizando una
extensión tras la resuspensión del
sedimento.
Leucocitos:el número total normal varía
según la edad:
neonatos: 0 – 30/µl
1- 5 años: 0 – 20/µl
6-18 años: 0 -10/µl
adultos: 0 – 5/µl.
Fórmula:
neutrófilos: 0 – 6 %
linfocitos: 40 – 80 %

Tabla 3. Valores normales de tipos de
células en el LCR. Modificado de referencia 9.
Pleocitosis es el termino con que se denomina
al aumento del contenido en células (superior a lo
normal), puede ser leve (hasta 30/µl), moderada (hasta
100/µl) o intensa (mas de 100/µl):
Pleocitosis moderada o intensa a predominio
linfocitario (meningitis tuberculosa; meningitis viral;
meningitis micótica; sífilis; poliomielitis
aguda).
Pleocitosis moderada o intensa a predominio
polimorfonucleres (meningitis bacteriana aguda; mas de
1000/µl es diagnóstico diferencial).
Pleocitosis leve a predominio polimorfonucleares o
linfocitario se observa en meningitis serosas; sinusitis,
otitis, sin constituir el cuadro meningítico
clásico completo).
Pleocitosis a predominio de eosinófilos,
se presenta en estados inmunológico reaccional
alérgico del tejido conectivo perivascular de la
leptomeninges.
Pleocitosis a predominio de células
plasmáticas, se da en procesos inflamatorios
crónicos del sistema nervioso o de sus
cubiertas.
El aspecto turbio / purulento del LCR depende de la
pleocitosis a predominio polimorfonuclear y estos lo hacen en
procesos bacterianos, por ello la meningitis tuberculosa que es
una patología de instalación crónica produce
pleocitosis a predominio linfocitario y en consecuencia el
aspecto es límpido ("cristal de roca").
Hematíes: normalmente no hay. Su aumento indica
la existencia de hemorragia intracraneal o punción lumbar
traumática. En este último caso se debe corregir el
número de células restando un leucocito por cada
700 hematíes.
Otra aplicación es la de corregir la
concentración de proteínas (1 mg por cada 1000
hematíes).
Macrófagos: aparecen dentro de las dos horas
después que los hematíes ingresan al LCR, o sea que
su presencia indica hemorragia.
Puede presentarse células malignas, como
linfoblastos, mieloblastos y monoblastos, procedentes de
leucemias. Excepcionalmente se diagnostican en el LCR sarcomas,
tumores germinales, etc. (9, 14, 15, 17, 19, 20, 21,
22).

Figura 8. Macrófagos en LCR.
Modificado de referencia 8.

Figura 9. Linfoblastos por leucemia
linfocítica aguda en LCR. Modificado de referencia
8.

Figura 10. Mieloblastos por leucemia
mielocítica aguda en LCR. Modificado de referencia
8.
3. 6. 5 Análisis bioquímico
Glucosa.
Procede de la glucosa sanguínea por mecanismos de
transporte activo y difusión por gradiente de
concentración.
Su presencia en el LCR recibe el nombre de glucorraquia,
con un valor normal igual al 60 % de la cifra de glucemia medida
simultáneamente a la extracción del LCR.
Su cifra normal es de 40 a 70 mg/dl en el
adulto y de 60 a 80 mg/dl en el niño. En recién
nacidos prematuros la concentración de glucosa es de 24 –
63 mg/dl y en los recién nacidos a término es de 34
– 119 mg/dl.
Hipoglucorraquia se la encuentra en meningitis
bacterianas y micóticas.
Hiperglucorraquia: se observa en
diabetes, virosis (meningitis, poliomielitis); uremia. Este
fenómeno se da porque lo usan leucocitos, células
neoplásicas, bacterias o por la inhibición de la
entrada de glucosa a causa de cambios en la BHE.
Se ha postulado que la relación
glucorraquia/glucemia menor de 0,36 se encuentra en el 100 % de
las meningoencefalitis bacterianas y todas las virales mayor de
0,35 (6, 9, 15, 17, 23).
Proteínas.
La concentración de proteínas del suero es
unas 200 veces la del LCR, lo cual explica la diferencia de color
entre ambos líquidos.
La composición proteica del LCR es
compleja.
Un 80 % de las proteínas del LCR proceden del
plasma, principalmente por mecanismos de difusión
pasiva.
También existen mecanismos de transporte activo.
El paso de proteínas desde el plasma hacia el LCR depende
de:
1) constantes físicoquímicas (radio y masa
molar, carga eléctrica)
2) concentración en el plasma
3) estado de la BHE.
El 20 % restante de proteínas del LCR se origina
por síntesis intratecal. El efecto final de la BHE es el
de mantener una concentración de proteínas en el
LCR con una relación de 1/350 respecto a la del
plasma.
La concentración y la composición de las
proteínas del LCR varían según su origen y
la edad del individuo. Así, la concentración de
proteínas más baja se encuentra en el LCR
ventricular, siendo intermedia en la cisterna, y superior en la
zona lumbar.
1 – 30 días | 20 – 150 |
1 – 90 días | 20 – 100 |
3 – 6 meses | 15 – 50 |
0,5 – 10 años | 10 – 30 |
10 – 40 años | 15 – 45 |
40 – 50 años | 20 – 50 |
50 – 60 años | 25 – 55 |
> 60 años | 30 – 60 |
Tabla 4. Valores de referencia normales
de proteína en LCR. Valores expresados en mg/dl.
Modificado de referencia 15.
Normalmente, se encuentran muy pocas proteínas en
el LCR, dado que son grandes moléculas que no cruzan la
BHE.
Las alteraciones en la concentración de las
proteínas en el LCR son debidas a:
1) aumento del paso de proteínas desde el plasma
hacia el LCR, ya sea por alteración de la BHE
o por obstrucción a la libre circulación del
LCR
2) aumento de la síntesis o de la
liberación de proteínas in
situ.
El estudio de las proteínas del LCR es
útil en el diagnóstico y seguimiento en las
siguientes situaciones:
1) para evaluar el grado de afectación de la BHE
consecutivo a la inflamación, el aumento de
permeabilidad de esta barrera conlleva un incremento
en la concentración de proteína en el
LCR
2) en la detección de procesos inflamatorios del
SNC
3) en procesos degenerativos-destructivos del SNC, en
los cuales existe una liberación de
proteínas específicas desde el mismo hacia el
LCR.
Los 3 puntos anteriores pueden ocurrir
simultáneamente en algunas enfermedades
neurológicas.
Disociación cito-proteica: se denomina
así cuando en el LCR se encuentra una pleocitosis sin
aumento de las proteínas o un aumento muy discreto. Se
presenta en afecciones inflamatorias del parénquima, de
moderada agresividad (encefalitis benignas); en procesos
inflamatorios como sinusitis; en procesos infecciosos
sistémicos (meningitis) .
Los aumentos de la concentración de
proteína en el LCR son más frecuentes que sus
disminuciones. Pueden deberse a:
1) punción lumbar traumática, con mezcla
de sangre periférica provocando un aumento en
la concentración de proteína a expensas de
proteínas plasmáticas
2) degeneración tisular (Parkinson, esclerosis
múltiple, Síndrome de Guillain
Barré)
3) obstrucción a la libre circulación del
LCR (compresiones medulares por tumor, hernia o
absceso)
4) mayor síntesis proteica en el SNC (aumento de
la síntesis de inmunoglobulinas por la
presencia en el SNC de infiltrados
linfoplasmocíticos, por ejemplo en la
esclerosis múltiple)
5) accidentes vasculares: embolia cerebral,
hemorragia
6) mayor permeabilidad de la BHE (inflamaciones e
infecciones, trastornos metabólicos y
tóxicos).
En este último caso importante recordar
que:
• en las meningitis agudas bacterianas, la
concentración de proteína en el LCR
suele ser superior a 1,5 g/l
• la concentración de proteína en el
LCR puede estar dentro del intervalo de referencia
hasta en un 10 % de las meningitis agudas bacterianas
• la concentración de proteína en el
LCR puede no estar elevada al inicio de distintos
tipos de meningitis
• sólo un 1 % de las meningitis
víricas cursa con concentraciones de
proteína en el LCR superiores a 1,7 g/l, frente a un
50 % de los casos de meningitis agudas
bacterianas.
Este aumento es inespecífico pero indicativo de
alguna enfermedad. Los aumentos de la concentración de
proteína en el LCR se deben con mayor frecuencia a
meningitis bacterianas y más raramente a otros procesos
inflamatorios, tumores, hemorragias y enfermedades
degenerativas.

Tabla 5. Causas del aumento de
proteína en el LCR. Modificado de referencia
15.
El estudio de la concentración de proteína
en el LCR reviste interés para establecer el
diagnóstico diferencial entre las meningitis bacterianas y
las no bacterianas, siendo ésta la principal
aplicación de la medición urgente de la
concentración de proteína en el LCR, en pacientes
que acuden con sintomatología neurológica
aguda.
El descenso en la concentración de
proteína se encuentra en los procesos que provocan
dilución del líquido, por ejemplo:
1) fuga de LCR por un desgarro dural (traumatismo
craneoencefálico, punción lumbar
previa, rinorrea u otorrea de LCR)
2) retirada de grandes volúmenes de LCR
(neumoencefalografías)
3) aumento de la presión intracraneal (puede
provocar una mayor filtración de LCR a
través de las vellosidades aracnoideas)
4) hipertiroidismo (mecanismo no aclarado).
Resultados elevados – Meningitis – Hemorragia – Tumores primarios del SNC – Esclerosis múltiple – Síndrome de Guillain – – Neurosífilis – Polineuritis – Mixedema – Enfermedad de Cushing – Enfermedad del tejido conectivo – Polineuritis – Diabetes – Uremia Resultados disminuidos – Pérdida del LCR/traumatismo – Punción reciente – Producción rápida de – Intoxicación hídrica |
Tabla 6. Causas clínicas de
valores anormales de proteínas del LCR. Modificado de
referencia 8.
Albúmina.
Disociación
albúmino-citológica: se denomina de esta
manera cuando en el LCR se encuentra una celularidad normal con
hiperproteinorraquia. Es propio de situaciones de bloqueo del
flujo del LCR a lo largo del conducto espinal por tumores,
procesos inflamatorios, entre otras causas. Se da también
en el síndrome de Guillain-Barré. Su grado maximo
es el denominado síndrome de Froin en el que la
elevada concentracion de proteínas da al líquido un
color amarillento.
La albúmina constituye un buen marcador del
intercambio entre el LCR y el plasma debido a su capacidad de
difusión a través de la BHE.
Los valores de referencia de la concentración de
albúmina en el LCR oscilan entre 12 y 32 mg/dl.
Puesto que la albúmina es de síntesis
hepática, toda la albúmina presente en el LCR
procede del plasma. Por lo tanto, la relación entre las
concentraciones de albúmina en el LCR y en el plasma
refleja la integridad de la BHE.

Tabla 7. Determinación del
cociente de albúmina. Modificado de referencia
24.
Valores entre 9 y 30 x 10-3 indican alteraciones
moderadas de la BHE; entre 30 y 100 x 10-3, alteraciones severas;
y superiores a 100 x 10-3, indican pédida de la integridad
anatómica y funcional de esta barrera. Así, por
ejemplo, una meningitis bacteriana ocasiona una mayor
disfunción de la BHE y, por lo tanto, un Qalb-LCR/suero
mayor que el síndrome de Guillain-Barré, y
ésta a su vez mayor que las meningitis
víricas.
En neonatos, los valores normales del cociente son
superiores a los del adulto, debido a la inmadurez de la BHE,
tendiendo a igualarse a partir de los 6 meses (6, 9, 15, 16, 17,
20, 25, 26).
Lactato deshidrogenasa (LDH).
Sus niveles normales son un 10 % de la concentracion
serica. Aumenta en traumatismos cerebrales, afecciones
degenerativas, convulsiones, meningoencefalitis y
tumores.
La LDH en LCR se eleva en la hemorragia del
SNC, pero no en la punción traumática;
también nos ayudan en el diagnóstico diferencial de
las meningitis bacterianas y víricas, ya que en casi el 90
% de las meningitis bacterianas la concentración de esta
enzima se encuentra elevada (9, 17, 27).
Cloruro.
Los valores normales se encuentran entre los 116 – 122
mmol/l. Aumenta en casos de hipercloremia. Las
hipoclorurorraquias ocurren en las hipocloremias y en las
meningitis tuberculosas y purulentas (17).
Lactato.
Los valores normales se encuentran entre 1 – 3
mmol/l.
Es independiente de la de lactato en sangre porque
éste no atraviesa la BHE. El lactato presente en el LCR es
el producto final de la glucólisis anaerobia tanto de los
leucocitos como de las bacterias, siendo el metabolismo
bacteriano, en caso de infección, la principal fuente de
lactato en el LCR.
Aumenta en infarto cerebral, edema, trauma, meningitis
bacteriana o fúngica pero no en la
vírica.
Debe comenzarse con un tratamiento antimicrobiano cuando
la concentración de lactato es =4 mmol/l, teniendo en
cuenta que por encima de >9 mmol/l conllevaría un mal
pronóstico (15, 20, 28).
Creatinquinasa (CK).
Su valor medio es inferior a 4 UI/l. Se eleva en
lesiones cerebrales isquemcas, HSA, Guillain-Barré (17,
27).
3. 6. 6 Método de tinción del LCR con
Tinta china
La meningitis crónica es causada por
Cryptococcus neoformans.
Las preparaciones con tinta china para C.
neoformans poseen una sensibilidad 25-50 % menor que las
pruebas de aglutinación con látex para el
antígeno criptococo. La especificidad es menor de 100 %,
por lo que algunos pacientes las células mononucleares
pueden repeler las partículas de carbón de tinta
china produciendo falsos positivos, evitándose con el uso
de nigrosina.
Método:
1) centrifugue suavemente el LCR para concentrar las
células en el fondo del tubo (2 minutos)
2) elimine el exceso de líquido (se guarda si son
necesarios exámenes posteriores)
3) extraiga una gota del fondo del tubo de centrifugado
y colóquela en el centro del portaobjetos
4) coloque una gota de tinta china en la gota de la
muestra; mezcle suavemente
5) tape con cubreobjetos
6) examine la muestra a 10 aumentos y confirme los
hallazgos a 40 aumentos (26, 29, 30).

Figura 11. Cryptococcus
neoformans por el método de tinción con Tinta
china. Modificado de referencia 26.
3. 6. 7 Resumen de los principales rasgos
diagnósticos de los distintos tipos de
meningitis en el LCR

Tabla 8. Modificado de referencia
17.
Líquido
pleural
3. 7. 1 Anatomía de la pleura
La pleura es una membrana que recubre el pulmón,
mediastino, diafragma y pared costal, de forma separada en cada
hemitórax.
Se establece la distinción entre pleura parietal
y visceral, en realidad se trata de una membrana contínua,
y la transición entre ambas pleuras se encuentra en el
hilio pulmonar (31).
3. 7. 2 Fisiopatología de la pleura
Formación y absorción del líquido
pleural (LP): las capas pleurales actúan como membranas
semipermeables de forma que pequeñas moléculas como
la glucosa tienen paso libre al espacio pleural, mientras que
macromoléculas como la albúmina lo tienen impedido;
de este modo las concentraciones de glucosa son similares a las
del plasma y es menor la de las proteínas.
El LP es un ultrafiltrado plasmático procedente
de la pleura parietal, y se absorbe en su mayoría por los
capilares viscerales, mientras que las proteínas se
recuperan por los capilares de la pleura parietal, normalmente
menos de 15 ml de líquido se encuentran en el espacio
pleural. Su reabsorción se realiza vía
linfática.
Su volumen normal oscila entre 0,1 y 0,2 ml/kg de peso
corporal, es de color claro, inodoro y su concentración
proteica se sitúa entre 1 y 1,5 g/dl.
En estado fisiológico, el LP contiene alrededor
de 1500 células/µl con predominio de monolitos (30 –
75 %) y de células mesoteliales (70 %), menos linfocitos
(2 – 30 %) y escasos neutrófilos (10 %), sin
glóbulos rojos.
El pH es alcalino, con una concentración de
bicarbonato incrementada en un 20 al 25 % con respecto a la
plasmática. Los niveles de glucosa de LP y plasma son
prácticamente iguales, el de LDH es inferior a la mitad
del valor plasmático.
Se considera patológico un volumen de LP que
pueda ser detectado ra- diológicamente. La causa
más frecuente de su aparición es la insuficiencia
cardíaca (ICC).
Mecanismos de producción del derrame pleural: el
derrame pleural (DP) se produce cuando velocidad de
formación supera a la de absorción.
a) Aumento de las presiones
hidrostáticas: al elevarse las presiones capilares de
la circulación pulmonar como en la insuficiencia
cardíaca o la sobrecarga de volumen se producirá un
trasudado.
b) Descenso de la presión
oncótica: como en el síndrome nefrótico
o la desnutrición extrema.
c) Aumento de la permeabilidad en la
microcirculación pleural: se produce cuando la pleura
se ve afectada por el proceso patológico, como en las
afecciones infecciosas, inflamatorias o tumorales. Da lugar a
exudados.
d) Alteración del drenaje
linfático: se compromete la reabsorción del
líquido. Es típico del DP recidivante o
persistente. Si existe rotura o bloqueo del
conducto torácico secundario a tumores,
traumático o posquirúrgico se producirá
quilotórax.
e) Movimiento de fluido desde el peritoneo: a
través de los linfáticos diafragmáticos (31,
32, 33, 34, 35, 36).

Tabla 9. Causas del DP. Modificado de
referencia 35.
3. 7. 3 Definiciones
Los DP se clasifican como trasudados o como
exudados.
| Página siguiente |
