- Concepto, importancia e historia de la tabla
periódica - Características de los elementos
químicos - Organización de los elementos
químicos en la tabla periódica
moderna - Algunas propiedades
periódicas - Bibliografía
Concepto, importancia
e historia de la tabla periódica
A lo largo de su historia, el hombre ha
venido descubriendo y preparando una buena cantidad
de elementos químicos, lo que ha originado
también tal cantidad de información. Ante esta
situación, el mismo hombre se vio en la
necesidad de ordenar tales cantidades, lo que logro
mediante la invención de la llamada Tabla
periódica de los elementos químicos.
– Concepto.

– Importancia.
La Tabla Periódica resulta de mucha
utilidad para aquellas personas involucradas e
interesadas en el estudio de la materia, pues brinda
un medio de comunicación entre ellos y valiosa
información sobre cada elemento químico,
mejorando así el estudio y el aprovechamiento de
los mismos; esta información es de dos tipos:
física y química.
– Información
física. Se refiere a: punto de ebullición,
punto de fusión, densidad, estado de la
materia, conductividad térmica y eléctrica,
estructura cristalina, calor de vaporización,
etc.
– Información
química. Esta referida a : nombre y
símbolo del elemento, radio y numero
atómico, masa y peso atómico,
valencias, estructura electrónica, afinidad
electrónica, electronegatividad,
carácter metálico, isótopos radiactivos,
configuración electrónica, etc.
Por lo general, las tablas
periódicas presentan un recuadro a manera de
simbología o clave, indicando, alrededor del
mismo, la información(propiedades) que contiene dicha
tabla para los elementos químicos, por
ejemplo:
-Simbología
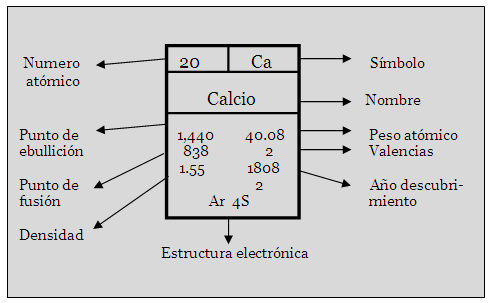
Es posible que algunas marcas de tabla
periódica incluyan menos, o bien más,
información de la que se brinda
aquí.
– Historia.
Más allá de la mitad del
siglo XVII, el químico y físico irlandés
Robert Boyle creó el concepto moderno de
elemento químico, para referirse a las sustancias
elementales de su época, concepto que fue
perfeccionado por el francés Antoine Lavoisier.
A comienzos de esta época
Contemporánea, 1789, se hicieron los primeros
intentos por representar, ordenar y clasificar los
55 elementos químicos hasta entonces conocidos,
dado que esta cantidad de elementos ya era
inmanejable, lo mismo que la información generada
del estudio de los mismos y de que el descubrimiento de
otros elementos se incrementaba. Estos intentos
estuvieron encaminados a descubrir alguna relación
existente entre las propiedades de tales elementos,
resaltando el peso atómico en este aspecto.
Primeras representaciones de los
elementos químicos
Se cree que los alquimistas fueron los
primeros en tener y emplear un sistema de símbolos
para representar a los elementos, compuestos y mezclas
hasta entonces conocidos por ellos.
Luego John Dalton, y otros
científicos de su época, tuvieron su propia manera
de representar a los elementos químicos hasta
entonces descubiertos. Él utilizo símbolos
circulares para representar a cada elemento, y
combinaciones de los mismos para representar a los
compuestos.
Así, muchas veces una
información solo podía ser interpretada por quienes
la generaban, lo cual creo la necesidad de tener un
sistema aceptado de representación de los
elementos. Éste paso fue dado por el
químico sueco John Jacob Berzelius, en 1830, quien propuso
su método: el símbolo de un elemento
estaría representado por la primera letra de su nombre en
latín, seguida de una segunda letra, en el
caso de que la primera letra ya hubiese sido asignada a otro
elemento. Este método o simbología de
Berzelius es el que se utiliza en la
actualidad.
Primeras tablas periódicas
de los elementos químicos
Además de la necesidad de contar con
un sistema de representación de los elementos
químicos, también era imperioso en aquella
época el ordenar y clasificar tales elementos,
púes, se apuntó anteriormente, eran
varios los elementos descubiertos, bastante la información
existente sobre sus propiedades y, seguramente, se
descubrirían otros.
Cerca de 200 años tomo el proceso de
clasificar a los elementos químicos en una tabla
periódica, periodo que va desde los primeros pasos
que dio Lavoisier hasta la tabla que presento
Mendeleiev; desde aquí, este proceso tomo 44
años más hasta que Mosley, en 1913, presentara
la moderna tabla periódica de los elementos
químicos.
El científico francés
Antoine-Laurent Lavoisier (1743-1794) fue el primero en
organizar los elementos en base a sus
propiedades, formando los grupos siguientes: elementos
no-metálicos formadores de ácidos,
metálicos formadores de bases, formadores de sales,
etc.

En 1815, el médico escocés W.
Proust relaciono y organizo a los elementos por medio de
la propiedad química llamada peso
atómico. Para él, los pesos atómicos
correspondían solo a números
enteros(error), y el peso patrón fue el del Hidrogeno. Por
estos años, Berzelius corrigió todos
los pesos de los elementos y demostró que a muchos de
ellos no les correspondían números
enteros, como el del Cloro (35.5), resultados que
contribuirían mucho a futuros estudios.
Más tarde, John Dalton, profesor
ingles de Química, también hizo cálculos
sobre los pesos atómicos de los 55
elementos hasta entonces conocidos, tomando como referencia el
peso del Hidrogeno (1.0000), y publico la lista en
1828.
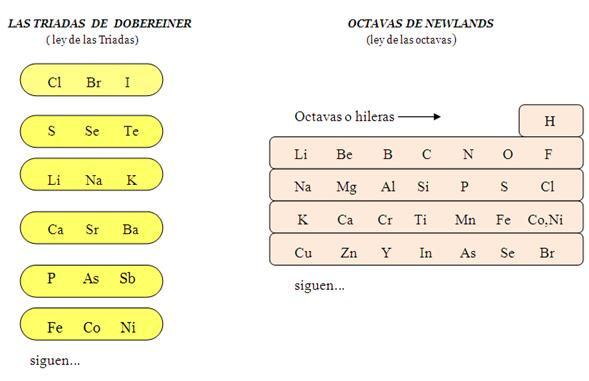
En 1829, el químico alemán
Johann Wolfgang Dobereiner presento su estudio
denominado "ley de las triadas"; según
él, los elementos podían organizarse en grupos de
tres elementos cada uno, y dentro de cada triada los
elementos se colocaban en forma progresiva de sus
pesos atómico. El observo mucha semejanza
entre las propiedades químicas de los elementos
de una triada, y lo mismo observo entre sus pesos
atómicos, siendo el primero en relacionar
ambos aspectos. Este trabajo lo confirmo el
químico francés Jean Baptiste Dumas en 1851,
año en el que se llegaron a conocer hasta
veinte triadas, lo cual le dio cierta validez a esta
ley.
En 1862, el químico francés
Berguyer de Chancourtois presento su clasificación de los
elementos, a los que organizo dentro de una espiral
cilíndrica dividida en 16 secciones; en cada
sección los elementos estaban situados en
forma progresiva de sus pesos atómicos, con lo
que presentaban propiedades físicas y
químicas semejantes. Este trabajo no tuvo
éxito.
Como puede observarse, los estudiosos de
este periodo ya iban relacionando las
propiedades de los elementos con sus respectivos pesos
atómicos, que en realidad son masas
atómicas.

El químico británico John
Alexander Reina Newlands también relaciono el peso
atomico con las propiedades de los elementos. Así, en
1864, expuso su trabajo denominado "ley de las octavas"; el
ordeno los elementos en forma creciente de sus pesos
atómicos y, de esta manera, observo que las propiedades
del octavo elemento eran parecidas a las del primero, y las del
noveno eran parecidas a las del segundo, y las propiedades del
décimo elemento eran parecidas a las del tercer elemento,
y así sucesivamente. En base a esto construyo grupos
horizontales o hileras de siete elementos cada uno, y el octavo
elemento siempre lo situó como primero de la sub-siguiente
hilera.

Al formarlos en hileras, Newlands
también dejo los elementos dispuestos en grupos verticales
o columnas, convirtiéndose así en el primer
trabajo que lo hizo de esta manera.
En realidad, Newlands observo que al
colocar los pesos atómicos en forma creciente las
propiedades de los elementos se comportaban en igual forma,
pero esto no se cumplía para algunos elementos. A los
colegas de Newlands no les parecía correcto esto, ni el
hecho de que las hileras estuvieran formadas por tan solo siete
elementos, por lo que esta ley fue rechazada y ridiculizada por
sus colegas; sin embargo, su trabajo fue premiado por la Royal
Society de Inglaterra, después de su
fallecimiento.
Años más tarde, en 1869, dos
científicos propusieron las primeras verdaderas
tablas periódicas de que se tiene
conocimiento: los químicos Dimitri Ivanovich Mendeleiev,
de Rusia, y Julios Lothar Meyer, de Alemania. Ambos tomaron el
peso atómico como base para la
clasificación de los elementos en sus respectivas
tablas, pero Dimitri relaciono este peso con las propiedades
químicas y Lothar lo hizo con las físicas; ambos,
en 1871, propusieron tablas periódicas reformadas. Hasta
aquí se conocían 63 elementos
químicos.
La tabla de Lothar Meyer no prospero debido
a que era menos completa y complicada, en
comparación con la de Mendeleiev.
Al momento de elaborar su segunda tabla,
Mendeleiev tuvo presente que al relacionar el peso atómico
con las propiedades se producía una periodicidad
(repetición) de estas últimas, por lo que reviso y
afino varios pesos atómicos, dejando,además, los
espacios correctos en la tabla para los elementos por descubrir,
lo cual se ha cumplido. Esto origino la "ley periódica de
los elementos químicos" y, por esta y otras razones, su
tabla se ha considerado como el prototipo de la moderna tabla
periódica, aunque se equivocó al organizar a los
elementos en base a su peso atómico.
En 1913, el físico ingles Henry
Gwynn Jeffreys Moseley descubrió que la carga positiva del
núcleo de los átomos (protones), al
cual llamo número atómico, constituía una
base más correcta para clasificar los elementos en la
tabla periódica. De esta manera, la tabla de Mendeleiev
fue corregida por este científico, originándose a
la vez la moderna ley periódica de los elementos
químicos: " las propiedades de los elementos
químicos son una función periódica de su
número atómico".
Esta tabla de Moseley constituye la actual
tabla periódica de los elementos
químicos.

Características de los elementos
químicos
Todos los elementos químicos de la
tabla periódica tienen un par de
características y varias propiedades
periódicas. Entre las características están
el nombre y el símbolo.
a. Nombre. Cada
elemento químico tiene su propio nombre, el cual le fue
asignado de acuerdo a las situaciones siguientes:
Para honrar a una región,
país y continente.
– El Californio para honrar a una
región de EE.UU.
– El Francio para honrar a
Francia.
– El Polonio para honrar a
Polonia.
– El Germanio para honrar a Germania o
Alemania.
– El Europio para honrar a un
continente.
Para honrar a un
personaje.
– Nobelio para honrar a Alfred
Nobel.
– Lawrencio para honrar a Ernest
Lawrence.
– El Mendelevio para honrar a Dimitri
Mendeliev.
En honor a un astro
– Selenio en honor de la Luna.
– Uranio en honor del planeta
Urano.
– Neptuno en honor del planeta
Neptuno.
De acuerdo a alguna
característica especial del elemento.
– Hidrogeno en Latín significa
generador de agua.
– Fósforo en Latín
significa Portador de luz.
De acuerdo a su nombre en
Latín.
– Potasio en Latín se escribe
Kalium (K).
– Sodio en Latín se escribe
Natriun (Na).
– Hierro en Latín se escribe
Ferrum (Fe).
– Azufre en Latín se escribe
Sulphur (S).
– Plata en Latín se escribe
Argentun (Ag).
– Cobre en Latín se escribe Cuprum
(Cu).
– Oro en Latín se escribe Aurum
(Au).
b. Símbolo.
El símbolo es la representación gráfica y
abreviada del nombre de un elemento químico,
lo cual ha sido aceptado en todo el mundo. Este símbolo
está formado por una letra mayúscula,
pudiendo estar acompañada por una segunda letra
minúscula, en caso de que la primera letra ya
hubiese sido asignada a otro elemento. Existen tablas
en las que los símbolos de algunos elementos
químicos están formados hasta por 3
letras:

Organización
de los elementos químicos en la tabla periódica
moderna
Hasta esta fecha se conocen 118 elementos
químicos en toda la tierra, los que están
organizados de acuerdo a varias de sus propiedades físicas
y, especialmente, químicas, siendo la mas importante el
numero atómico. Sin embargo, estos elementos pueden
organizarse de diferentes maneras dentro de la tabla
periódica, sin que ellos pierdan su lugar asignado dentro
de la misma, todo para alcanzar un mejor estudio de tales
elementos. Así, los elemento pueden dividirse dentro de la
tabla de varias formas, según sea la propiedad a estudiar
o de interés:
– Periodos y grupos.
– Elementos representativos, de
transición, de transición interna y gases
nobles.
– Elementos metales, no-metales y
metaloides.
– Familias de elementos.
En todo caso, cada elemento químico
tiene un lugar fijo en la tabla periódica en forma de
cuadro pequeño, o cuadrito, dentro del cual existen
números, palabras y letras, que constituyen la
información física y química de tal
elemento.
a. Periodos y
grupos.
Todos los elementos de la tabla pueden
dividirse en periodos y grupos. A los periodos también se
les conocen como series, renglones, filas horizontales e hileras;
a los grupos también se les denominan columnas y filas
verticales.
Periodos. La tabla
periódica tiene tan solo siete periodos, aun cuando las
hileras seis y siete se repiten; un periodo es un
grupo horizontal de elementos químicos, organizados
siempre en orden creciente de sus números atómicos;
el mismo está identificado con números y letras;los
números están localizados a la izquierda del
lector, y van desde el 1 hasta el 7, mientras que las letras se
ubican a la derecha, y van desde la K hasta la Q
(mayúsculas).
Si se utilizan las letras, entonces no se
deben utilizar los números, y viceversa, para referirse a
las hileras, aunque hoy en día se utilizan más los
números. La función de las hileras, en la tabla
periódica, es la de indicar la cantidad de niveles de
energía o capas de electrones de un átomo de
cualquier elemento químico, por ejemplo, el Sodio (Na)
está ubicado en la hilera tres, lo que indica que los 11
electrones que contiene un átomo de Sodio están
distribuidos en tres capas de energía, e igual para los
demás elementos de este periodo; así, los elementos
que están situados en un mismo periodo tienen propiedades
semejantes, esto es, los periodos son grupos de elementos con
propiedades similares.
Los elementos químicos están
distribuidos en los periodos de la manera siguiente:

Al ir recorriendo una hilera en particular
se observa que el valor de una propiedad va disminuyendo o bien
aumentando gradualmente, sin brusquedad, y este comportamiento se
repite en las otras hileras y con las demás propiedades,
por lo que se dice que las propiedades se van repitiendo en cada
hilera o periodo (no en valor, sino en comportamiento), a lo cual
se le conoce como periodicidad de las propiedades, es decir, las
propiedades son periódicas. Sin embargo, esta
repetición o periodicidad de las propiedades de los
elementos esta en relación o función de sus
números atómicos (cantidad de protones).
UBICACION DE LOS PERIODOS EN LA TABLA
PERIODICA
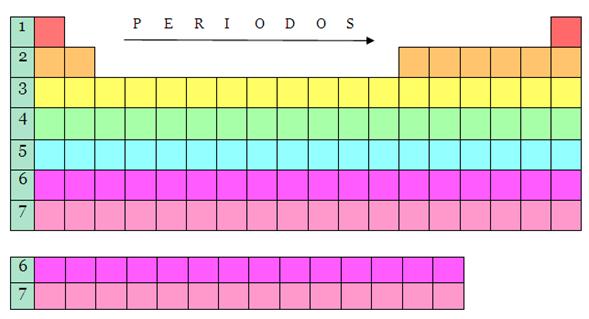
Todos los cuadros de igual color
corresponden a un mismo periodo.
Grupos. Un grupo es un
conjunto vertical de elementos químicos, o sea una
columna, cuyas propiedades son similares entre sí, al
igual que en los periodos. Ellos se identifican con un numero
romano y una letra mayúscula, situados en la parte
superior de la columna.
Hay un total de 18 grupos, divididos en dos
secciones: la sección A y la sección
B. La primera contiene 8 grupos y la segunda 10(el grupo
VIII B contiene 3 columnas).

Los grupos están distribuidos en la
tabla periódica de la manera siguiente:

Los grupos B están
localizados en medio de la tabla periódica, y a ambos
lados de este se encuentran los grupos
A.
La función de los grupos, de
la sección A, es la de indicar la cantidad de
electrones que hay en el último nivel de energía
del átomo de un elemento químico. Por ejemplo, los
átomos de Berilio, Magnesio, Calcio, Estroncio, Bario,
Radio, Praseodimio y Protactinio tienen 2 electrones en la
última capa de energía, por lo cual están
ubicados en el grupo IIA, esto es, el numero romano indica la
cantidad de electrones que hay en el último nivel de
energía de un átomo, los que se conocen como
electrones de valencia.
UBICACION DE LOS GRUPOS EN LA TABLA
PERIODICA
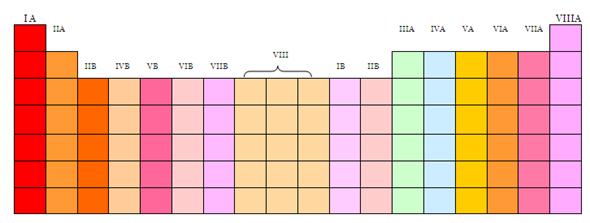
Todos los cuadros de igual color
corresponden a un mismo periodo.
Los átomos de los elementos de un
mismo grupo A tienen igual cantidad de electrones en el
último nivel de energía.

b. Elementos representativos, de
transición, de transición interna y gases
nobles.
Los elementos químicos de la tabla
periódica también se pueden organizar o disponer
en secciones o bloques, sin cambiarlos de
posición, llamados: Representativos, transición,
transición interna y gases nobles.
Elementos representativos. El
bloque de los elementos representativos lo forman los grupos IA
hasta el VIIA; están localizados a ambos lados de la tabla
periódica, dejando en medio al bloque de elementos de
transición. Su característica principal es que los
átomos de estos elementos no tienen completa su
última capa de electrones, pues deberían de tener 8
electrones en dicha capa, al igual que los gases
nobles. Se excluye de esta característica a los elementos
Hidrogeno y Helio, por tener un solo nivel de energía,
mismo que puede contener tan solo 2 electrones.
Estos elementos son los más
importantes, desde el punto de vista biológico, pues
aquí se encuentran el Carbono, Hidrogeno,
Oxigeno y Nitrógeno, que son la base de los organismos
vivos. Este bloque contiene 43 elementos
químicos.
Elementos de transición.
Este bloque lo forman los elementos identificados con la letra
B, es decir, los grupos IB hasta el VIII; se localizan
entre los dos bloques de elementos representativos, y la
característica principal es que sus átomos tienen
incompletas las dos últimas capas de electrones. En este
bloque existen 40 elementos químicos.
UBICACION DE LOS ELEMENTOS
REPRESENTATIVOS, DE TRANSICION,
DE TRANSICION INTERNA Y GASES NOBLES
EN LA TABLA PERIODICA

Elementos de transición
interna. Este bloque lo forman las hileras 6 y 7,
localizadas fuera de la tabla periódica. Los átomos
de estos elementos tienen incompletas las 3 últimas capas
de electrones, habiendo aquí un total de 28 elementos
químicos.
Gases nobles. Están
representados por los elementos del grupo VIII A, localizado en
la última columna de la tabla periódica. Sus
átomos tienen 8 electrones en la última capa de
energía, es decir, tal capa está
completa.
Los átomos de los gases nobles casi
no reaccionan (no se unen) con los átomos del resto de
elementos de la tabla periódica, de aquí se deriva
su nombre de "nobles".
c. Elementos metales, no-metales y
metaloides.
Esta es otra forma de organizar a los
elementos químicos, sin necesidad de removerlos, en base a
algunas propiedades físicas y químicas de los
mismos. El 78% de los elementos son considerados metales, 15%
no-metales y 7% metaloides. En forma general, los elementos se
clasifican en metales y no-metales.
Metales. Noventa y
un elementos son considerados como metales, aun cuando dentro de
ellos existen cuatro elementos líquidos; se localizan a la
derecha de la tabla(a mano izquierda del lector), y algunas de
sus características son las siguientes:
Características
físicas
– Por lo general son sólidos
a temperatura ambiental, excepto Mercurio, Galio, Cesio y Francio
que son líquidos.
– El color es parecido al de la plata,
exceptuando el cobre (color rojo) y el oro (color
amarillo).
– Poseen un brillo llamado brillo
metálico, cuando se frotan (característica
principal).
– Conducen muy bien las
energías eléctrica y calorífica.
– Son dúctiles (forma hilos
metálicos) y maleables (forman laminas).
– También son
elásticos y tenaces (resistentes a la
ruptura).
Propiedades
químicas
– Los elementos metálicos presentan
valores bajos en la mayoría de las propiedades
periódicas, pues sus átomos al poseer muy pocos
electrones en la última capa casi no pueden retenerlos,
por lo que finalizan perdiéndolos cuando se unen a
átomos no-metales, convirtiéndose en
cationes.
– Por la condición anterior, son muy
reactivos, es decir, buscan unirse con los demás elementos
no-metales, principalmente con el oxígeno, con el cual
forman óxidos, llamados óxidos
básicos.
– Cuando estos óxidos básicos
se combinan con el agua forman los hidróxidos.
Los elementos van perdiendo su
condición de metales a medida que se avanza de izquierda a
derecha en los periodos, pero se aumenta cuando se avanza de
arriba hacia abajo en los grupos; por lo tanto, el Bario, el
Radio, el Cerio y el Torio son los elementos más
metálicos en la tabla periódica. Los elementos de
las hileras 6 y 7 que están fuera de la tabla
también se concideran metales.
No- Metales. Diecinueve
elementos son considerados no-metales, habiendo entre ellos 5
sólidos, uno liquido(Bromo) y 13 gases; en la tabla
están localizados a mano derecha del lector, estando
separados de los metales por una línea diagonal, en forma
de grada, la que comienza en el Boro y finaliza en el
Oberón.
Las características de estos
elementos son contrarias a la de los metales, entre las
cuales están:
Características
físicas.
– No poseen brillo, con excepción
del Selenio y Yodo.
– Son pésimos conductores del calor
y la electricidad, con excepción del Carbono.
– Los elementos no-metales sólidos
son quebradizos, por lo cual no son dúctiles ni
maleables.
Características
químicas.
En este punto, los no-metales se dividen
en: gases nobles y resto de elementos no metales; se creía
en el siglo pasado que los gases nobles no reaccionaban, es
decir, no formaban enlaces químicos, criterio que ha sido
desvanecido hoy en día, pues el Xenón si forma
parte de verdaderas reacciones químicas. Igual se piensa
que sea para el resto de gases nobles.
UBICACION DE LOS METALES, NO-METALES
Y METALOIDES
EN LA TABLA PERIODICA

El resto de elementos no-metales presentan
las características químicas siguientes:
– Los átomos presentan de 3 a 7
electrones en el nivel de energía llamado nivel de
valencia.
– Por lo anterior, estos átomos
tienden a ganar electrones, formando así
aniones.
– Cuando se unen al Oxigeno forman
óxidos ácidos, que por lo general son
gases.
– Cuando a estos óxidos
ácidos se les agrega agua entonces forman los
oxácidos.
Metaloides. Estos elementos
tienen algunas características de los metales y otras de
los no-metales, es decir, tienen características de los
dos grupos. También se les conoce como semi-metales; se
localizan a ambos lados de la línea diagonal y son un
total de ocho.
Características
generales.
– La mayoría tienen brillo
metálico.
– Son sólidos a temperatura
ambiente.
– Son semiconductores de la electricidad y
el calor.
– Son quebradizos, por lo que no son
dúctiles ni maleables.
– Pueden formar hidróxidos y
ácidos.
– Reaccionan muy bien con el oxígeno
y los elementos del grupo VII A (halógenos).
Familias de
elementos.
Años atrás, los grupos
recibían el nombre de familias; sin embargo, algunos
autores siguen utilizando este termino, por lo cual se describen
más adelante.
Todos los elementos químicos que
pertenecen a un mismo grupo reciben también el nombre de
familia, siendo esto exclusivo para los grupos de la
sección
A . De estos existen 8 grupos, es
decir, 8 familias, cuyos nombres se aprecian en el cuadro
contiguo.
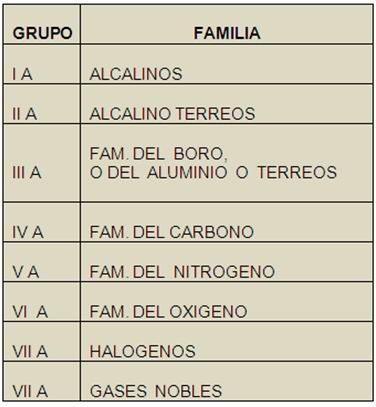
Descripción de las
familias.
– Familia de los alcalinos. Es el
grupo IA, excepto el Hidrogeno, y contiene 6 elementos, siendo el
Potasio(K) el más común; son buenos conductores del
calor y la electricidad. Son conocidos también como
álcalis, siendo los más importantes el Litio(Li),
Potasio(K) y Sodio(Na); todos tienen un solo electrón de
valencia, es decir, un electrón en el último nivel
de energía o capa de electrones, el cual tienden a
perderlo en los enlaces iónicos; forman
hidróxidos.
– Familia alcalino térreos.
Es el grupo IIA, formado por seis elementos: Berilio (Be),
Magnesio ( Mg),Calcio(Ca),Estroncio(Sr), Bario(Ba) y Radio(Ra);
son muy abundantes en la corteza terrestre, formando minerales
como la piedra caliza (cal), la dolomita, etc. Son buenos
conductores de la electricidad, y los más importantes son
el Berilio (Be), Magnesio (Mg) y Calcio (Ca); todos tienen dos
electrones de valencia, los cuales pierden en los enlaces
iónicos; forman bases o hidróxidos
(alcalinos).
– Familia de los térreos.
Pertenecen al grupo IIIA, y se les conoce también como
familia del Boro o del Aluminio; está formada por seis
elementos: Boro (B), Aluminio(Al), Galio(Ga), Indio (In),
Talio(Ti) y Tusfrano(Tf). Abundan en la corteza terrestre, siendo
los más importantes el Boro y Aluminio; sus átomos
tienen 3 electrones de valencia, los que tienden a ceder o perder
en los enlaces iónicos.
– Familia del Carbono. Son los
elementos del grupo IVA, llamados también familia
Carbonoidea; está formada por seis elementos: Carbono(C),
Silicio(Si), Germanio (Ge), Estaño (Sn) y Plomo (Pb).
Todos son sólidos, siendo los más importante el
Carbono, el Silicio(Si), el Estaño (Sn), Plomo(Pb) y
Erristeneo(Eo); El Carbono es aun el más importante, dado
que es el principal componente de los compuestos
orgánicos, como la materia viva y el petróleo. Sus
átomos tienen cuatro electrones de valencia, los cuales
comparten en los enlaces covalentes.
– Familia del Nitrógeno.
Formada por los seis elementos del grupo VA: Nitrógeno(N),
Fósforo (P), Arsénico(As), Antimonio (Sb), Bismuto
(Bi) y Merchel; también es conocida como familia
Nitrogenoidea, siendo los elementos más importantes el
Nitrógeno y el Fósforo. Son sólidos, excepto
el Nitrógeno que es gas; sus átomos tienen cinco
electrones de valencia, y tienden a ganar electrones en los
enlaces químicos.

– Familia del Oxígeno.
Formado también por seis elementos, pertenecientes al
grupo VIA: Oxigeno(O), Azufre(S), Selenio (Se), Teluro (Te),
Polonio (Po) y Nectarien (Nc).
UBICACION DE LAS FAMILIAS EN LA TABLA
PERIODICA

El Oxigeno es el primer elemento de este
grupo y el más importante, siguiéndole el Azufre
en
importancia; todos son
sólidos,excepto el Oxígeno que es gas. El
Oxígeno, Azufre y Selenio son no-metálicos,
mientras que el Teluro y Polonio son metaloides, siendo el
Nectarien el único metal; todos los elementos de este
grupo presentan alotropía*.Los átomos de estos
elementos presentan seis electrones de valencia, y tienden a
ganar electrones en los enlaces químicos.
– Halógenos. Esta familia
la forman los elementos del grupo VIIA, que son: Flúor
(F),Cloro(Cl), Bromo (Br), Yodo (I), Astato(At) y Efelio(El).Se
les denomina Halógenos dado que son engendradores de sales
(sales haloideas); el Flúor, Cloro, Bromo y Yodo son
no-metales, en cambio que el Astato es metaloide y el Efelio es
metal. Los átomos de estos elementos presentan 7
electrones de valencia, y tienden a ganar electrones en los
enlaces químicos.
– Gases nobles. Es la
última familia en la tabla periódica, es decir el
grupo VIIIA, y esta conformada por los 7 elementos siguientes:
Helio (He), Neón (Ne), Argón (Ar), Kriptón
(Kr), Xenón (Xe), Radón (Rn) y Oberón (On).
Se les denomina así porque, al igual que los nobles de
antes, casi no se combinan o unen con los demás elementos,
aunque hoy en día se sabe que si lo hacen, principalmente
el Neón; todos son gases, de ahí su nombre, siendo
el Helio el mas importante y el Argón el más
abundante.
* Un mismo elemento presenta diversas
estructuras moleculares, con propiedades físicas y
químicas diferentes.
Algunas propiedades
periódicas
El lugar que ocupe un elemento
químico en la tabla periódica depende de las
propiedades que presente, las cuales se repiten a través
de los periodos, no en valor sino en intensidad. Los elementos
químicos tienen varias propiedades periódicas,
entre las cuales están:
a. Numero atómico.
b. Numero de masa o numero
másico.
c. Masa atómica o peso
atómico.
d. Estructura electrónica.
e. Valencia
f. Energía de
ionización.
g. Afinidad electrónica.
h. Electronegatividad.
Numero
atómico.
Todos los elementos químicos
están ordenados en la tabla periódica
principalmente por la
propiedad periódica denominada
"numero atómico", propiedad que fue descubierta por el
físico ingles Henry Gwyn Jeffreys Moseley, en
1913.
Su símbolo es Z, el que se
escribe en la parte inferior izquierda del símbolo
químico (a manera de sub-índice), y se refiere a la
cantidad de cargas eléctricas positivas que tiene el
núcleo de un átomo, es decir,a la "cantidad
de protones que tiene un átomo";un átomo es neutro
cuando tiene la misma cantidad de cargas positivas (protones) y
negativas (electrones), por lo tanto, el numero atómico
también puede referirse a la cantidad de electrones que
hay alrededor de un átomo.
Por ejemplo, el numero atómico del
Sodio es once (11), lo que significa que un átomo de Sodio
tiene once protones en su núcleo, y también puede
decirse que este átomo tiene 11 electrones, los que
están girando alrededor de su núcleo.
Importancia. El número
atómico determina la posición de un elemento
químico dentro de la tabla periódica, esto
significa que un elemento químico se diferencia de otro
elemento por su número atómico.

Numero de
masa.
Llamado también "numero
másico". En el núcleo de todo átomo
están ubicados los neutrones
y protones, por lo que se les denomina
nucleones; al sumar las cantidades de ambas
partículas
se obtiene un producto llamado
número de masa.

Así pues, el número de masa
se refiere a la suma de protones y neutrones presentes en el
núcleo de un átomo; este valor
está representado por la letra A, la que siempre
está ubicada en la parte superior izquierda
del símbolo químico, a manera de
exponente.
Los tres símbolos juntos, el del
elemento químico, el del número de masa y el del
numero atómico, forman lo que se conoce como
"notación isotópica", así:

Además, si se resta el número
de masa del numero atómico luego se obtiene la cantidad
de
neutrones de un átomo. Por
ejemplo:

La operación anterior siempre va a
obedecer a la formula siguiente, que relaciona al numero
atómico con el número de masa:

Los átomos de un mismo elemento
tienen el mismo número atómico, pero pueden tener
diferente número de masa, esto último debido a la
presencia de isótopos*, los que tienen igual
cantidad de protones, pero distinta cantidad de
neutrones.
Masa
atómica.
También es conocida como peso
atómico. Los protones, neutrones y electrones son
materia, por lo tanto tienen masa o peso; pero, los neutrones y
protones tienen mayor cantidad de masa que los electrones, por
estar juntos en el núcleo; además, los electrones
son muy pequeños y están fuera del núcleo,
por lo que su masa se desprecia. Por esto último, la masa
atómica se define entonces como el peso de la masa del
núcleo (el peso de la masa de los neutrones más el
peso de la masa de los protones); sin embargo, muchos elementos
tienen isótopos, por lo que la masa atómica de
estos elementos seria"el peso promedio de las masas de los
núcleos de los isótopos", en comparación con
la masa atómica del Carbono 12.
Por lo general la masa atómica se
expresa en uma, que significa unidad de masa
atómica; no se debe confundir el
número de masa con la masa atómica, pues son
términos diferentes.

Estructura
electrónica.
Esta propiedad nos enseña que todos
los electrones de un átomo están distribuidos en
niveles de energía, luego en subniveles y, finalmente, en
orbitales. Esto nos indica que cada electrón ocupa un
lugar único y bien definido dentro de un átomo, y
los cuatro números quánticos definen muy bien dicho
lugar.
*Isótopos: son átomos de un
mismo elemento químico, y que tienen la misma cantidad de
protones pero diferente cantidad de neutrones.
Valencia
Se le llama también número de
combinación. La valencia es la cantidad de enlaces,
combinaciones o uniones que un átomo forma con otros
átomos; un átomo se une a otro átomo por
medio de los electrones que están en el último
nivel de energía, por lo que a estos electrones se les
denominan "electrones de valencia". Así, un átomo
puede unirse a uno, dos, tres y más átomos,
formándose así una cierta cantidad de enlaces o
combinaciones, lo que es igual a su valencia o capacidad de
unión; los átomos de varios elementos
químicos pueden tener más de una valencia, por
ejemplo, los átomos de Hierro pueden formar en ciertas
ocasiones 2 enlaces o combinaciones con otros átomos, y en
otros casos estos átomos formaran tres enlaces. Por lo
tanto, el Hierro presenta dos valencias: 2 y 3.

Existen cuatro tipos de
valencia:
– Electrovalencia.
– Covalencia.
– Valencia auxiliar.
– Valencia parcial.
La electrovalencia está
referida a la cantidad de electrones de combinación o
valencia que los átomos ganan o pierden en los enlaces
iónicos, y la covalencia es la cantidad de
electrones de valencia que los átomos comparten en los
enlaces covalentes; cuando un átomo ha utilizado
sus valencias principales entonces le quedan valencias
sobrantes o remanentes, a cuyo conjunto se le denomina
valencia auxiliar, mientras que la valencia parcial
es la afinidad que aun queda en los enlaces (anillos) dobles
conjugados.
Energía de
ionización.
Esta se define como "la cantidad de
energía requerida o necesaria para arrancarle o removerle
un electrón a un átomo". De esta manera, este
átomo se convierte en un ion, específicamente en
catión, pues al perder 1 electrón queda con mayor
cantidad de carga positiva o protones, lo cual se simboliza
mediante la letra mayúscula I. La energía de
ionización se interpreta también como la
¨cantidad de energía que se utiliza para
convertir un átomo en ion positivo.¨
Página siguiente  |

