- Introducción
- Moléculas
- ¿En qué consiste el modelo de
Lewis? - Modelo
atómico de Bohr - Gilbert Newton Lewis
- Bibliografía
Introducción El
químico estadounidense Lewis dio una definición
acerca del comportamiento de los ácidos y de las bases.
Según esta, una base sería una especie que puede
donar un par de electrones, y un ácido la que los puede
aceptar.
El ácido debe tener su octeto de
electrones incompleto y la base debe tener algún par de
electrones solitario. El amoníaco es una base de Lewis
típica y el trifluoruro de boro un ácido de Lewis
típico. La reacción de un ácido con una base
de Lewis da como resultado un compuesto de adición. Los
ácidos de Lewis tales como el tricloruro de aluminio, el
trifluoruro de boro, el cloruro estánnico, el cloruro de
cinc y el cloruro de hierro (III) son catalizadores sumamente
importantes de ciertas reacciones orgánicas.
De esta forma se incluyen sustancias que se
comportan como ácidos pero no cumplen la definición
de Brønsted y Lowry, y suelen ser denominadas
ácidos de Lewis. Puesto que el protón, según
esta definición, es un ácido de Lewis (tiene
vacío el orbital 1s, en donde "alojar" el par de
electrones), todos los ácidos de Brønsted-Lowry son
también ácidos de Lewis:
Electrones de ValenciaEl
número total de electrones representados en un diagrama de
Lewis es igual a la suma de los electrones de valencia de cada
átomo.
La valencia que se toma como referencia y
que se representa en el diagrama es la cantidad de electrones que
se encuentran en el último nivel de energía de cada
elemento al hacer su configuración
electrónica.
Cuando los electrones de valencia han sido
determinados, deben ubicarse en el modelo a
estructurar.
Una vez que todos los pares solitarios han
sido ubicados, los átomos, especialmente los centrales,
pueden no tener un octeto de electrones. Los átomos entre
sí deben quedar unidos por enlaces; un par de electrones
forma un enlace entre los dos átomos. Así como el
par del enlace es compartido entre los dos átomos, el
átomo que originalmente tenía el par solitario
sigue teniendo un octeto; y el otro átomo ahora tiene dos
electrones más en su última
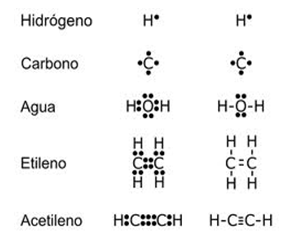
capa.MoléculasLas moléculas más
simples, entre las cuales se encuentran las moléculas
orgánicas, deben presentar un átomo central, en
algunos casos el átomo central es
el carbono debido a su baja electronegatividad, luego
éste queda rodeado por los demás átomos de
las otras moléculas. En moléculas compuestas por
varios átomos de un mismo elemento y un átomo de
otro elemento distinto, éste último se utiliza como
el átomo central, lo cual se representa en este diagrama
con 4 átomos de hidrógeno y uno
de silicio. El hidrógeno también es un
elemento exceptuante, puesto que no debe ir como átomo
central.
¿En qué consiste el modelo
de Lewis?en todo el mundo los elementos químicos se
representan de la misma forma, no importa el idioma que se hable
si vemos el símbolo Li, sabemos que estamos ablando del
litio. Esto se conoce como leguaje químico y es muy
útil para abreviar la representación
matemática de las reacciones como has visto en otros
temas. Como se mencionó antes, los electrones de los
últimos niveles de energía son muy importantes en
química y de ahí la necesidad de representarlos.
Una manera de hacerlo es por medio de modelo de Lewis, el cual
consiste en escribir el símbolo del elemento y alrededor
de este número de puntos igual que el número de
electrones que se encuentran en el último nivel de
energía (electrones de valencia). Por ejemplo, el litio
tiene un solo electrón en su último nivel de
energía, por lo que se representa como Li  el símbolo del
el símbolo del
elemento representa el núcleo atómico los puntos,
los electrones de valencia.
Modelo atómico de
Bohr
Postulados de BohrNeils Bohr, que los
electrones giran a grandes velocidades alrededor del
núcleo atómico, esta forma los electrones
están ubicados en órbitas circulares, las cuales
determinan diferentes niveles de energía.Bohr se
basó en el átomo de hidrógeno para realizar
el modelo, el intentaba realizar un modelo atómico capaz
de explicar la estabilidad de la materia y los espectros de
emisión que se observan en los gases. Describió el
átomo de hidrógeno con un protón en el
núcleo, y girando a su alrededor un electrón. La
regla del octeto Dice que la tendencia de los átomos
de los elementos es completar sus últimos niveles de
energía con una cantidad de electrones tal que adquiere
una configuración semejante a la de un gas noble, es
decir, con 8 electrones.La regla del octeto es muy útil
para la explicación de la formación de enlaces
entre los átomos.
¿Cómo se enlazan los
átomos para formar moléculas?
En sus
investigaciones, los químicos han observado que los gases
nobles, como el neón y el argón son
químicamente muy estables. Puede suponerse que esta
estabilidad se debe a que tiene 8 electrones en su último
nivel de energía. La gran mayoría de los elementos
químicos no se encuentran libre en la naturaleza forman
parte de diversas sustancias. Por ejemplo, el cloro no se
encuentra en forma de átomos (Cl), si no de
moléculas (Cl2). Esto se representa con el modelo de
Lewis.
Gilbert Newton Lewis
En
1916 Gilbert Newton Lewis propuso que el enlace covalente entre
átomos se produce por compartición de pares de
electrones, mecanismo por el que cada uno individualmente
podría alcanzar ocho electrones en su capa más
externa.El fundamento de este principio hay que buscarlo en la
denominada regla del octeto, consecuencia del desarrollo del
modelo de Bohr y del descubrimiento de los gases nobles,
sustancias de notable inercia química y ocho electrones en
su capa de valencia.Para alcanzar el octeto electrónico
los átomos pueden compartir más de un par de
electrones (enlace simple), dando lugar a enlaces
múltiples. Se denomina orden o multiplicidad de enlace al
número de pares de electrones compartidos. Las estructuras
de Lewis son representaciones en las que mediante puntos o
guiones se indica la distribución de electrones de
valencia (enlazados o solitarios) en los átomos de las
moléculasTeoría ácido-base de
LewisGilbert Newton Lewis químico
estadounidense que en 1938 formuló la
teoría del enlace covalente donde propuso que no
todas las reacciones ácido-base implican transferencia de
protones, pero sin embargo forman siempre un enlace covalente
dativo.
Propuso la escritura de fórmulas
utilizando puntos para resaltar los electrones.
Ácido: Sustancia que
puede aceptar un par de electrones de otros grupos de
átomos, para formar un enlace covalente dativo.
(H+)
Base: Sustancia que tiene pares
de electrones libres, capaces de ser donados para
formar enlaces covalentes dativos. (OH-)
El ácido debe tener su octeto de
electrones incompleto y la base debe tener algún par de
electrones solitarios. La reacción de un
ácido con una base de Lewis da como resultado
un compuesto de adición.
Ejemplo: Estructura de Lewis para el ion
nitrito
La fórmula del ion de nitrito es
NO2-
Pasó uno: Escoger el
átomo central. Existe sólo un
átomo de nitrógeno, y es el átomo con
menos electronegatividad, por lo que éste se
convertirá en nuestro átomo central.Pasó dos: Contar los
electrones de valencia. El nitrógeno posee 5
electrones de valencia; cada oxígeno posee 6, para un
total de (6 x 2) + 5 = 17. El ion posee una carga de -1, lo
que nos indica un electrón extra, por lo que el
número total de electrones es de 18.Pasó tres: Ubicar los pares
electrónicos. Cada oxígeno debe ser
enlazado al nitrógeno, que usa cuatro electrones, dos
en cada enlace. Los 14 electrones restantes deben ser
ubicados inicialmente como 7 pares solitarios. Cada
oxígeno debe tomar un máximo de 3 pares
solitarios, dándole a cada oxígeno 8
electrones, incluyendo el par del enlace. El séptimo
par solitario debe ser ubicado en el átomo de
nitrógeno.Paso cuatro: Cumplir la regla del
octeto. Ambos átomos de oxígeno poseen
8 electrones asignados a ellos. El átomo de
nitrógeno posee sólo 6 electrones asignados.
Uno de los pares solitarios de uno de los oxígenos
debe formar un doble enlace, y ambos átomos se
unirán por un doble enlace. Puede hacerse con
cualquiera de los dos oxígenos. Por lo tanto, debemos
tener una estructura de resonancia.Paso cinco: Dibujar la
estructura. Las dos estructuras de Lewis deben ser
dibujadas con un átomo de oxígeno doblemente
enlazado con el átomo de nitrógeno. El segundo
átomo de oxígeno en cada estructura
estará enlazado de manera simple con el átomo
de nitrógeno. Ponga los corchetes alrededor de cada
estructura, y escriba la carga ( - ) en el
rincón superior derecho afuera de los corchetes.
Dibuje una flecha doble entre las dos formas de
resonancia.
Los subíndices que aparecen en las
fórmulas químicas de compuestos covalentes expresan
el número de átomos que se combina para formar una
molécula y están, por tanto, relacionados con la
capacidad de enlace de cada uno de ellos, también llamada
valencia química. Según la teoría de Lewis,
la configuración electrónica de la capa externa
condiciona dicha capacidad y es la responsable del tipo de
combinaciones químicas que un determinado elemento puede
presentar.Enlaces: Teoria de Lewis
Ante la diversidad de elementos químicos
existentes en la naturaleza cabe preguntarse cuál es la
razón por la que unos átomos se reúnen
formando una molécula y otros no; o de otra manera, por
qué no toda molécula o agrupación de
átomos imaginable tiene existencia real. Una primera
respuesta puede hallarse en la tendencia observada en todo
sistema físico a alcanzar una condición de
mínima energía. Aquella agrupación de
átomos que consiga reducir la energía del conjunto
dará lugar a una molécula, definiendo una forma de
enlace químico que recibe el nombre de enlace
covalente.
Junto con esa idea general de configuración de
energía mínima, otros intentos de
explicación de este tipo de enlace entre átomos han
sido planteados recurriendo a las características
fisicoquímicas de las estructuras electrónicas de
los átomos componentes.
Ambos átomos, que individualmente considerados
tienen siete electrones en su capa externa, al formar la
molécula de yodo pasan a tener ocho mediante la
comparación del par de enalce .Existen moléculas
cuya formación exige la comparación de más
de un par de electrones. En tal caso se forma un enlace covalente
múltiple. Tal es el caso de la molécula de
oxígeno O2:

para cuya formación se comparten dos pares de
electrones. Representado cada par de electrones mediante una
línea resulta:

que indica más claramente la
formación de un doble enlace.En la molécula de
nitrógeno N2 sucede algo semejante, sólo que en
este caso se han de compartir tres pares de electrones para
alcanzar el octete, con la formación consiguiente de un
triple enlace:

Esta explicación puede extenderse al caso de las
moléculas formadas por átomos de elementos no
metálicos diferentes entre sí, tales como HCl o NH3
por ejemplo:

Lewis contempló la posibilidad extrema de que los
pares electrónicos de enlace fueran aportados por un
sólo átomo. Tal es el caso del ion amonio en el
cual el átomo de nitrógeno aporta el par de
electrones al enlace con el ion H+:

Este tipo de enlace covalente se
denomina coordinado.
Los subíndices que aparecen en las
fórmulas químicas de compuestos covalentes expresan
el número de átomos que se combina para formar una
molécula y están, por tanto, relacionados con la
capacidad de enlace de cada uno de ellos, también llamada
valencia química. Según la teoría de Lewis,
la configuración electrónica de la capa externa
condiciona dicha capacidad y es la responsable del tipo de
combinaciones químicas que un determinado elemento puede
presentar.
Enlace iónico o electro
Valente
Cuando el enlace ocurre por transferencia
de electrones los átomos que participan provienen de
elementos electropositivos (pierden electrones) (metales) y de
elementos electronegativos que (ganan electrones) (no metales),
hay formación de iones positivos y negativos. A este tipo
de enlace se le conoce con el nombre de "Enlace
Iónico," en este siempre participan átomos
cuya diferencia de electronegatividad es igual o mayor de 1,7 con
sus excepciones. Al enlace Iónico también se le
conoce con el nombre de enlace electro Valente, debido a que
cuando los átomos se enlazan intercambiando electrones,
forman fuerzas de atracción electrostáticas (cargas
+ y cargas – ).
PROPIEDADES DE LOS COMPUESTOS
IÓNICOS
1) Son sólidos.
2) Poseen puntos de fusión MUY
elevados, mayores de 400° C
3) Conducen electricidad, en
disolución acuosa o fundidos contienen partículas
con carga móviles (iones).
4) Son solubles en solventes polares, como
el agua.
5) Son frágiles, sus cristales se
rompen fácilmente si se golpean.
6) Forman estructuras cristalinas
iónicas donde se alternan los iones de carga
opuesta.
7) Son insolubles en solventes no
polares.
Bibliografía
Sofia Elizondo
