Introducción
Las plantas ejercen gran influencia en todos los
procesos que transcurren en nuestro planeta. Al realizar la
nutrición autótrofa, bajo la acción de la
energía solar, transforman el dióxido de carbono
(CO2(g)), aguas y sales minerales en complejos compuestos
orgánicos.
Todo el ciclo complejo de la síntesis de
compuestos orgánicos nitrogenados en las plantas comienza
con el amoniaco (NH3) y su degradación termina
también con la formación de amoniaco.
La síntesis de aminoácidos y
proteínas en las plantas se realiza a cuenta del
nitrógeno que se absorbe del ambiente exterior.
La absorción más intensa de las plantas y
su utilización para la producción de
aminoácidos y proteínas tiene lugar en el
período de máximo crecimiento y formación de
los órganos vegetativos como tallos y hojas. En los
órganos crecientes más jóvenes predominan
los procesos de síntesis de proteínas, y en los
más viejos los procesos de degradación.
Aminoácidos
Los aminoácidos pueden existir libres en el
tejido vegetal y animal o formando parte de los péptidos y
las proteínas. Tienen diversas funciones
biológicas, forman parte de importantes compuestos
biológicos como vitaminas, hormonas y algunos son
intermediarios de ciclos metabólicos.
Independientemente de las importantes funciones que
tiene los aminoácidos la fundamental es ser las unidades
estructurales que conforman los péptidos y las
proteínas.
Se considera que los aminoácidos son los
productos iniciales de la asimilación del
nitrógeno. Experimentalmente se ha demostrado que
siguiendo la asimilación de nutrientes inorgánicos
que contienen N15 se ha puesto de manifiesto que en la
mayoría de los compuestos receptores iniciales del
nitrógeno son los ( cetoácidos libres del
citoplasma.
1.1 Estructura.
Los aminoácidos constituyen una importante clase
de compuestos orgánicos que contienen al menos un grupo
amino (-NH2) y un grupo carboxilo (-COOH). Veinte de estos
compuestos son los constituyentes de las proteínas y se
los conoce como ?aminoácidos (a-aminoácidos). Todos
ellos responden a la siguiente fórmula general:

 Como
Como
muestra dicha fórmula, los grupos amino y carboxilo se
encuentran unidos al mismo átomo de carbono, llamado
átomo de carbono alfa. Ligado a él se encuentra un
grupo variable (R). Es en dichos grupos R donde las
moléculas de los veinte ?aminoácidos se diferencian
unas de otras. En la glicina, el más simple de los
aminoácidos, el grupo R se compone de un único
átomo de hidrógeno. En otros aminoácidos el
grupo R es más complejo, conteniendo carbono e
hidrógeno, así como oxígeno,
nitrógeno y azufre.

Numerosas investigaciones que se han realizado han
demostrado que los aminoácidos que se encuentran en las
proteínas vegetales son los siguientes.
Glicina, Alanina, Valina, Leucina, Isoleucina, Serina,
Treonina, Fenilalanina, Tirosina, Triptófano, Cistina,
Cisteína, Metionina, Prolina, Hidroxiprolina, Ácido
Aspártico, Ácido Glutámico, Histidina,
Arginina y Lisina.
Tabla No.1 Estructura de los
aminoácidos.
Nombre | Estructura | Abreviatura |
Glicina |
| Gli |
Alanina |
| Ala |
Valina |
| Val |
Leucina |
| Leu |
Isoleucina |
| Ile |
Serina |
| Ser |
Treonina |
| Tre |
Fenilalanina |
| Phe |
Tirosina |
| Tir |
Triptófano |
| Trp |
Cisteína |
| Cis-Cis |
Metionina |
| Met |
Prolina |
| Pro |
Hidróxiprolina |
| Hip |
Ácido |
| Asp |
Ácido |
| Glu |
Histidina |
| His |
Arginina |
| Arg |
Lisina |
| Lis |
Cisteína Cis

Los ( cetoácidos son parecidos a los
aminoácidos, diferenciándose por tener un
oxígeno unido al carbono alfa ((), en lugar de tener un
grupo amino (NH2). Se puede decir también que los
aminoácidos son ácidos aminados ya que tienen el
grupo carboxílico (-COOH) y el grupo amino (-
NH2).
1.3 Clasificación de los
Aminoácidos.
Existen diversas formas de clasificar los
aminoácidos:
Atendiendo a su composición química se
clasifican en neutros, ácidos y
básicos.Los aminoácidos neutros son los que tienen un
grupo carboxílico (- COOH) y un grupo amino
(-NH2).Los aminoácidos ácidos son los que
presentan dos o mas grupos carboxílico (- COOH) y un
grupo amino (-NH2).Los aminoácidos básicos son los que
tienen un grupo carboxílico (- COOH) y dos o mas
grupos aminos (-NH2).

Atendiendo a la polaridad de la molécula se
clasifican en aminoácidos polares y no
polares.

1.4 Nomenclatura.
Si se tiene en cuenta el sistema oficial de nomenclatura
(UIQPA) los aminoácidos son considerados como un
ácido orgánico con un hidrógeno de la cadena
carbonada sustituido por un grupo amino (-NH2) y al nombrarlos se
considera el número del átomo de carbono donde se
encuentra unido el grupo amino en la cadena principal del
ácido, por ejemplo:

No obstante lo señalado anteriormente se debe
considerar que para estos compuestos se utiliza generalmente la
nomenclatura común.
1.5 Propiedades Físicas.
Se ha demostrado experimentalmente que los
aminoácidos son sustancias cristalinas. Por lo general
solubles en agua y en soluciones acídicas o básicas
diluídas.
Son insolubles o muy poco solubles en alcohol, son
insolubles en éter, aunque algunos tienen un
comportamiento contrario. Por ejemplo: La cisteína es poco
soluble en agua, la prolina es soluble en éter y
alcohol.
Los aminoácidos tienen un punto de fusión
alto que sobrepasa los 2000 C y algunos los 3000 C. Aunque a
temperaturas por encima se descomponen, siendo muy difícil
separarlos por destilación fraccionada.
Propiedades ópticas de los
aminoácidos.
Todos los aminoácidos presentan actividad
óptica. Esto se debe a que estos compuestos tienen la
propiedad de desviar el plano de vibración de la luz
polarizada a favor o en contra de las manecillas del reloj es
decir a la derecha o a la izquierda, ello se determina
experimentalmente en un polarímetro.
La actividad óptica de los aminoácidos se
debe a que el carbono alfa de los mismos constituye un centro
estereogénico, con la excepción de la
glicina.
Cuando se determina experimentalmente que un
aminoácido es dextrógiro, ello quiere decir que
desvía el plano de vibración de la luz polarizada
hacia la derecha y se representa por el signo más (+). Si
la desviación se produce hacia la izquierda se denomina
levógiro y se representa por el signo menos (-), conceptos
estudiados en el Capítulo No I.
Se puede afirmar que los aminoácidos que
pertenecen a la serie L son aquellos que el grupo alfa amino
(-NH2) está orientado hacia el mismo lado que el OH del L
Gliceraldehído, es decir hacia la izquierda y los que
pertenecen a la serie D tienen la configuración similar al
D Gliceraldehído, hacia la derecha.
Se debe tener presente que el poder rotatorio del
aminoácido dextrógiro (+) o levógiro (-) que
se determina en el polarímetro no tiene que coincidir con
la serie D o L a la que pertenezca el
aminoácido.
Por ejemplo el a.a. L (+) ácido Glutámico,
es dextrógiro con un poder rotatorio específico de
12,00 y pertenece a la serie L, sin embargo la L (-) Leucina
pertenece a la serie L y tiene un poder rotatorio
específico de – 11,0O es decir es
levógiro.
Punto Isoeléctrico de un
Aminoácido.
Se puede plantear que el punto isoeléctrico es un
valor del pH en el cual el aminoácido presenta carga neta
cero y en un campo eléctrico no migra ni hacia el
ánodo ni hacia el cátodo.
El punto isoeléctrico es una
característica particular de cada aminoácido. Por
ejemplo para la glicina es de 6,0, para la fenilalanina 5,5, para
el ácido glutámico 3,2 etc.
En este punto isoeléctrico el aminoácido
se encuentra fundamentalmente es su forma de ión dipolar o
Zwitteriön.
De acuerdo a la relación entre los valores de pH
del medio y del P.I. de los aminoácidos,
predominará una u otra forma de sus posibles especies
iónicas. Y por tanto, la carga neta variará
también en función de esta
relación.
La misma puede considerarse para fines prácticos
como se señala a continuación.
Sí El amino ácido. presenta
pH ( PI Carga neta positiva
pH = PI Carga neta cero
pH ( PI Carga neta negativa
Para los aminoácidos neutros el P.I. (
6
Para los aminoácidos ácidos el P.I. (
6
Para los aminoácidos básicos P.I. (
6
1.6 Propiedades químicas de los
aminoácidos.
Los aminoácidos manifiestan muchas de las
reacciones características de los ácidos
carboxílicos y de las aminas alifáticas,
también se ha demostrado que el grupo amino participa en
diversas reacciones importantes en la determinación
cualitativa y cuantitativa de los aminoácidos.
Reacciones por los grupos
carboxilo.
El grupo carboxilo de los aminoácidos experimenta
reacciones de descarboxilación, formación de sales,
formación de aminas por
descarboxilación.
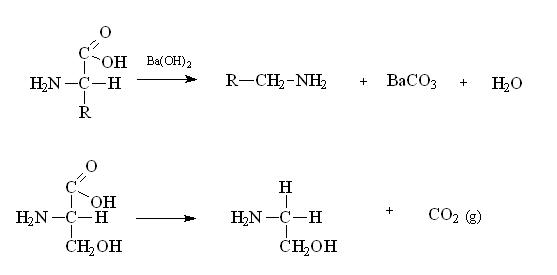
Descarboxilación.
En los aminoácidos al reaccionar con el
hidróxido de Bario Ba(OH)2 en presencia de calor, se
produce la descarboxilación y se forman las aminas
biógenas, sustancias de gran importancia biológica.
En el organismo esta reacción ocurre por la acción
catalítica de la enzima descarboxilasa.
Formación de Amidas.
Los aminoácidos forman amidas al reaccionar sus
ésteres con el amonio o con aminas.

En el segundo caso se formará una amida. Este es
el tipo de enlace que une a los aminoácidos entre
sí para formar los péptidos y
proteínas.
Formación de Sales.
Los aminoácidos forman sales debido a las
reacciones tanto del grupo carboxilo como del grupo amino, cuando
se les adicionan bases o ácidos
respectivamente.

a) Reacciones por grupo
amino.b) Reacción con el ácido
nitroso.
El ácido nitroso reacciona con el grupo amino de
los a.a. formando los ácidos hidroxilados
correspondientes, liberando nitrógeno gaseoso.

Esta es la reacción que se utiliza para
determinar el nitrógeno del grupo amino, se conoce como
procedimiento de Von Slyke y sirve para estimar los grupos aminos
libres de los péptidos y las proteínas midiendo la
cantidad de nitrógeno liberado.
c) Reacción con el 1- Flúor-2,4
– dinitrobenceno (FDNB).

Los grupos aminos de los a.a. reaccionan con el FDNB
(reactivo de Sanger) en solución básica y se forman
dinitrobenceno aminoácidos de color amarillo brillante.
Esta reacción se emplea para la determinación de
los aminoácidos N-terminales de péptidos y
proteínas.
Esta reacción se conoce como método de
Sanger por haber sido descubierta por Frederick Sanger
(1945-1950) trabajo que lo hizo acreedor del premio Nobel y que
culminó en la determinación de la estructura
completa de la Insulina.
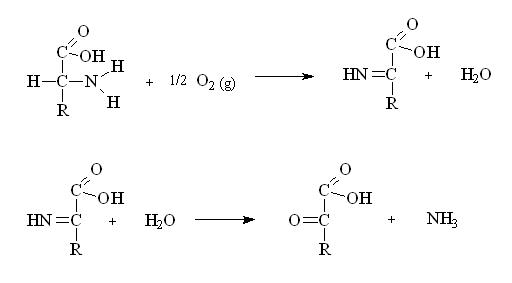
d) Desaminación Oxidativa.
El grupo amino puede ser liberado de los
aminoácidos por oxidación.
Los sistemas enzimáticos de algunos tejidos
catalizan la desaminación oxidativa de los
aminoácidos, convirtiéndolos en sus
ceto-ácidos correspondientes con eliminación del
amoniaco. Esta reacción ocurre en dos etapas.
e) Reacción con la
ninhidrina.
La reacción de la ninhidrina es una de las
reacciones más utilizadas para la identificación de
los aminoácidos. En esta reacción que transcurre a
altas temperaturas, intervienen dos moléculas de
ninhidrina por cada molécula de aminoácido, se
produce la liberación de CO2 (g), NH3 y se forma un
complejo de color violeta conocido como Púrpura de
Ruhemann.

Cuando la ninhidrina reacciona con el aminoácido
este se oxida a aldehído y la ninhidrina se reduce a
hidridantina. Esta última reacciona con otra
molécula de ninhidrina y con el amoniaco producido en la
primera reacción, formándose un producto coloreado
azul.
Esta reacción es muy importante ya que es la base
de un método colorimétrico de valoración de
aminoácidos.
1.7 Importancia.
Los ?-aminoácidos son la base estructural de las
proteínas y sirven de materia prima en la obtención
de otros productos celulares, como hormonas y pigmentos.
Además, varios de estos aminoácidos son
intermediarios fundamentales en el metabolismo
celular.
La mayoría de las plantas y microorganismos son
capaces de utilizar compuestos inorgánicos para obtener
todos los aminoácidos necesarios en su crecimiento, pero
los animales necesitan conseguir algunos de los
?-aminoácidos a través de su dieta. A estos
aminoácidos se les llama esenciales, y en el ser humano
son: lisina, triptófano, valina, histidina, leucina,
isoleucina, fenilalanina, treotina, metionina y arginina. Todos
ellos se encuentran en cantidades adecuadas en los alimentos de
origen animal ricos en proteínas, y en ciertas
combinaciones de proteínas de plantas.
Aparte de los aminoácidos de las
proteínas, se han encontrado en la naturaleza más
de 150 tipos diferentes de aminoácidos, incluidos algunos
que contienen los grupos amino y carboxilo ligados a
átomos de carbono separados. Estos aminoácidos de
estructura poco usual se encuentran sobre todo en hongos y
plantas superiores.
Péptidos
Los péptidos son polímeros de
aminoácidos de menor masa que las proteínas. Cuando
contienen menos de diez aminoácidos se denominan
oligopéptidos, y los que tienen más de diez,
polipéptidos.
Los péptidos se pueden definir a como aquellos
compuestos que se forman por la unión de dos o más
aminoácidos mediante enlaces peptídicos liberando
una o más moléculas de agua.
2.1 Estructura.
En los péptidos los
aminoácidos se hallan unidos por los llamados enlaces
peptídicos entre sus grupos carboxilo (COOH) y amino
(NH2)
Experimentalmente se han demostrado las
características de este enlace como se puede observar en
la siguiente figura.

La distancia entre el nitrógeno y el carbono en
el enlace peptídico es de 0.132nm en vez de 0.147nm que
posee el enlace simple C-N.
Este acortamiento del enlace peptídico se debe a
que el mismo posee cierto carácter de doble enlace
(aproximadamente un 5.0%). Este carácter de doble enlace
determina que el mismo no puede girar libremente lo que da lugar
a dos consecuencias importantes para la estructura del
péptido.
Los átomos del enlace peptídico se
encuentra en el mismo plano.Debido a la rigidez dada por este enlace, son
posibles dos configuraciones (CIS Y TRANS) de las cuales solo
la TRANS se ha observado en los péptidos y
proteínas.
2.2 Clasificación.
Los péptidos se clasifican de acuerdo a la
cantidad de aminoácidos que lo forman en:
Dipéptidos, si contienen dos
aminoácidos.Tripétidos, si contienen tres
aminoácidos.Tetrapéptidos, si contienen cuatro
aminoácidos, etc.
2.3 Nomenclatura.
Para nombrar los péptidos se comienza por el
aminoácido que tenga el grupo amino libre,
añadiéndole al nombre del aminoácido la
terminación IL, se continúa nombrando de
igual forma todos los aminoácidos que le siguen y el
último mantiene el nombre completo. Por ejemplo el
péptido formado por glicina, tirosina y alanina recibe el
nombre de valilalanilglicina.

También para representar la estructura de los
péptidos en forma simplificada se acostumbra a utilizar
las abreviaturas de los aminoácidos constituyentes unidos
por un guión cuando el orden sea conocido, o por una coma
cuando solo se conozca su composición, en el caso
representado Val-Ala-Gli.
Propiedades químicas
Hidrólisis
Se ha demostrado que el enlace peptídico es un
enlace fuerte en determinadas condiciones. Pero si se
añade una molécula de agua a un dipéptido,
se logra la ruptura de los enlaces peptídicos y la
consecuente separación de los aminoácidos
contenidos en el péptido, por ejemplo.
Hidrólisis de la
alanilglicina

La hidrólisis también se produce
adicionando ácidos, bases o determinadas
enzimas.
Cuando la hidrólisis es ácida, se
utilizan, ácidos fuertes. Uno de los más utilizados
es el ácido clorhídrico HCl a C(x/zx) = 6 mol.l-1 y
temperatura de 1100C que actúa durante varias horas. De
esta forma los péptidos se hidrolizan completamente dando
una mezcla de aminoácidos.
Es bueno aclarar que en estas condiciones el
triptófano se destruye totalmente y además hay
pequeñas pérdidas de serina y treonina.
Para la hidrólisis básica se emplea
generalmente el hidróxido de sodio NaOH caliente, con esta
hidrólisis se destruyen la arginina, treonina, serina,
cistina y cisteina y además racemizan todos los
aminoácidos, por ello su utilidad fundamental es la
determinación del Triptófano.
Cuando la hidrólisis se efectúan en
condiciones más suaves, no se destruyen todos los enlaces
peptídicos y se producen las mismas parcialmente, dando
lugar a la formación de péptidos de cadenas
más pequeñas.
En cuanto a la hidrólisis enzimática se
utilizan distintas enzimas proteolíticas como la Tripsina,
Quimotripsina, la Pepsina, etc.
Se ha demostrado experimentalmente que estas enzimas,
catalizan el rompimiento de determinados enlaces
peptídico. Por ejemplo la Tripsina rompe aquellos enlaces
peptídico cuyo grupo carboxílico pertenece a la
Lisina o a la Arginina, mientras que la Quimotripsina solo ataca
los enlaces cuyo grupo carboxilo pertenece al Triptófano,
la Tirosina o la Fenilalanina.
La hidrólisis enzimática se lleva a cabo
en condiciones no drásticas y a temperaturas
aproximadamente de 370C para que no se destruyan los
aminoácidos, pero se necesita un tiempo bastante
prolongado, no se rompen todos los enlaces y las propias enzimas
por ser proteínas, constituyen contaminantes
medios.
Este procedimiento es de gran utilidad cuando lo que se
necesita es una hidrólisis parcial, contribuyendo de esta
forma a determinar la estructura de un polipéptido o de
una proteína.
2.5 Importancia.
Los péptidos tienen gran significación
como constituyentes de las proteínas, son compuestos
orgánicos que se encuentran en la mayoría de los
tejidos vivos, con múltiples funciones
biológicas.
Proteínas
El término proteína se introdujo
por Mulder (1839) como la derivación de la palabra griega
Protelos (que significa primero).
Las proteínas como los péptidos son
sustancias formadas por la unión de muchos
aminoácidos. Son sustancias nitrogenadas que se encuentran
en el protoplasma de todas las células animales y
vegetales. Su composición varia de acuerdo a su origen,
aproximadamente contiene carbono de 46 a 55%; hidrógeno de
6 a 9%, oxígeno de 12 a 30%; nitrógeno de 10 a 32%;
azufre de 0,2 a 0,3%
También pueden tener otros elementos por ejemplo
fósforo las nucleoproteínas, hierro la Hemoglobina,
etc.
Las masas moleculares de las proteínas son muy
altas y presentan valores que median entre 1500 y 20 000 000 para
las diferentes proteínas.
Las proteínas son de naturaleza coloidal, con
puntos de fusión característicos, aunque algunas se
han obtenido en forma cristalina. Todas son ópticamente
activas (levógiros).
3.1Estructura.
Las proteínas son una familia muy
heterogénea debido a la alta masa molecular que presentan
las moléculas proteicas y están constituidas por
una cantidad determinada de diversos
aminoácidos.
El estudio de las estructuras de las proteínas,
es fundamental para poder comprender la biogénesis de las
mismas, su función biológica y sus relaciones con
otros componentes de la célula, independientemente de tipo
de proteína, con el objetivo de analizar más
detalladamente su estructura, es conveniente establecer
determinados niveles de organización o
estructuras.
3.2 Niveles de organización
estructural: los niveles de organización
estructural de las proteínas son estructura primaria,
estructura secundaria, estructura terciaria y estructura
cuaternaria.
Estructura Primaria.
Llamada también nivel de organización
primario se caracteriza por el ordenamiento en que se encuentran
los aminoácidos en la cadena peptídica, organizada
por la repetición de las moléculas de
aminoácidos.
Solo un grupo de átomos integra la cadena
peptídica, por ejemplo el nitrógeno amídico,
el carbono alfa y el carbono carbonílico. El resto de las
moléculas de los aminoácidos se proyectan hacia
fuera de la cadena y constituyen los grupos R.
Como el enlace peptídico es un enlace covalente,
toda la estructura de la cadena la forma un esqueleto covalente,
lo cual explica la estabilidad y resistencia de esta
estructura.

Estructura primaria de una
proteína
La estructura primaria de una proteína es su
secuencia de aminoácidos, formada cuando un enlace
peptídico une el grupo carboxilo (un átomo de
carbono (C), dos átomos de oxígeno
(O) y un átomo de hidrógeno (H)) de
un aminoácido al grupo amino (un átomo de
nitrógeno (N) y dos átomos de
hidrógeno (H)) de otro. Así se forma una
cadena larga de varios aminoácidos, desprendiéndose
una molécula de agua en la formación de cada enlace
peptídico.
La cantidad de diferentes aminoácidos encontrados
en las proteínas es de 20, aunque en algunas
proteínas pueden encontrarse más de 20.
Independientemente de su composición aminoacidica, cada
proteína está caracterizada por una determinada
secuencia, es decir, el orden en que se encuentran situados los
aminoácidos es la cadena. Esta secuencia está
determinada genéticamente.
Se ha determinado que la cantidad de posibles secuencias
es muy grande.
Por ejemplo:
Si una cadena peptídica tiene 100
aminoácidos, podrá dar lugar teóricamente a
20100 secuencias posibles, valor extremadamente
grande.
Si se tiene en cuenta que existen diversas
proteínas con más de 100 residuos, se puede
concluir la gran cantidad de moléculas proteicas
posibles.
Para determinar la secuencia de los aminoácidos
en las proteínas se utilizan métodos
químicos y físicos. Entre los métodos
químicos se incluye la determinación del grupo
aminoterminal utilizando 1- Flúor – 2,4 –
dinitro benceno (FDNB) o con el cloruro de bencilo, y la
determinación secuencial de los aminoácidos a
partir del grupo amino libre, mediante el reactivo de Edman o
fenil – Isotiocianato.
Para el fraccionamiento parcial de las cadenas
peptídicas se utilizan enzimas proteolíticas como
la tripsina, pepsina y otras. También se utiliza como
reactivo químico el bromuro de
cianógeno.
Existen métodos físicos utilizados para
determinar la masa molecular de las proteínas como la
ultracentrifugación analítica, la medida de la
presión osmótica o la filtración de
geles.
Además para la separación de
aminoácidos y péptidos se emplean los
métodos cromatográficos de la capa fina, papel y
columna así como la electrofloresis.
La primera secuencia completa de una proteína, la
hormona Insulina, fue obtenida en 1953 por Frederik Sanger y
colaboradores. A partir de ese momento se han determinado las
secuencias de numerosas proteínas como la Ribonucleasa, la
lisozima, la hormona ACTH etc.
Estudios realizados de las diferentes secuencias que se
conocen hasta este momento han permitido llegar a algunas
conclusiones generales.
Las proteínas están constituidas por L
– aminoácidos unidos por enlaces
peptídicos. Otros enlaces covalentes son
raros.La composición y el orden de los
aminoácidos es muy variable.Las secuencias repetidas en una proteína no
son comunes.Cada proteína particular tiene una secuencia
única.
Los estudios realizados en cuanto a que las
proteínas particulares presentan una secuencia
única, demuestran el hecho de que esta secuencia se
establece genéticamente, es decir, que son los genes los
que portan la información de la misma y la trasmiten de
una generación a otra.
Si se produce una diferencia en este mecanismo, que
determine cambios en la secuencia de aminoácidos y de
variantes anormales en la proteína, se producirán
anormalidades y enfermedades en los organismos vivos.
Estructura secundaria.
Se conoce también por nivel de
organización secundaria y está dado por nivel de
ordenamiento que presenta la cadena peptídica a lo largo
del eje, producido por la interacción de grupos carbonilo
y amídico por interacciones por puentes de
hidrógeno.
Se ha determinado que las interacciones por puentes de
hidrógeno que se establecen cuando este elemento se
encuentra entre dos elementos ligeros y más
electronegativos. Se consideran enlaces relativamente
débiles, aproximadamente de 9,3 a 19 kJ/mole. Gran
número de estas interacciones pueden integrarse a expensas
de los grupos amídicos y caboníliços
posibilitando la formación de estructuras con gran
estabilidad.
Las estructuras que se pueden formar se reducen a unos
pocos tipos, ya que existen diversos factores que condicionan o
limitan las posibilidades existentes.
El conocimiento de esto se inició debido a los
trabajos de Linus Pauling y Robert Corey al utilizar la
técnica de difracción de rayos x con amidas
sustituidas y pequeños péptidos. Estos logran medir
las distancias y ángulo del enlace
peptídico.
Los siguientes requisitos, postulados inicialmente por
Pauling y Corey han sido demostrados
experimentalmente.
Todos los aminoácidos pertenecen a la serie
L.Todos los átomos anexos al enlace
peptídico están en el mismo plano y en la
configuración "TRANS"Estos planos solo pueden girar en cierta medida unos
con relación a otros en sus puntos de unión
constituidos por los carbonos alfa (()Los residuos de los aminoácidos no
contribuyen a la estructura.La formación de los puentes de
hidrógeno, solo se verificará cuando la
distancia entre el hidrógeno y el oxígeno no
sea mayor de 0,28 nm y los átomos del enlace formen
aproximadamente una línea recta.

Tipos de estructuras secundarias.
Las interacciones por puentes de hidrógeno pueden
lograrse entre varias cadenas peptídicas que corran
paralelas unas con otras.
Estas cadenas pueden correr en el mismo sentido o en
sentidos opuestos dando lugar a ordenamientos paralelos o
antiparalelos. En esta estructura las cadenas peptídicas
adoptan una forma plegada donde los sucesivos planos que
contienen las cadenas peptídicas formarán
ángulos entre sí al nivel del carbono alfa (??, que
adopta una estructura en Zig – Zag que Pauling
nombró hoja plegada o conformación beta
(().
En esta conformación los grupos R se proyectan
por encima y por debajo de la hoja y son paralelos entre
sí, lo cual favorece la estabilidad de la
estructura.
La hoja plegada se presenta en algunas proteínas
fibrosas como la fibroína de la seda y las ( -queratinas
presentes en escamas, picos y garras de aves y
reptiles.
 La
La
estructura en hoja plegada de las proteínas, presenta una
estructura en zig – zag, los puentes de hidrógeno se
establecen entre el – C = 0 y el – N- H de cadenas
vecinas, los radicales R se proyectan por encima y por debajo de
la hoja, las cadenas corren en sentido opuesto.
Otra conformación de la cadena favorecida
energéticamente es aquella donde los puentes de
hidrógeno se producen dentro de la misma cadena
peptídica.
Esta estructura fue denominada por Linus Pauling, Helice
( y se caracteriza porque la cadena peptídica se dobla
formando un arrollamiento helicoidal donde los puentes de
hidrógeno se forman entre una esfera y la siguiente y son
paralelas al eje de la hélice.
Entre las características de la hélice
alfa está la de poseer 3,6 aminoácidos por
vuelta, la que de encontrarse el arrollamiento hacia la derecha y
la de existir una distancia entre esferas (período de
identidad aminoácidos se proyectan hacia fuera de la
hélice.
Estructura terciaria.
La estructura terciaria de una proteína es su
forma tridimensional producida por los dobleces de sus cadenas de
polipéptidos. Estos dobleces no se presentan al azar, bajo
las condiciones ambientales adecuadas sólo se producen en
una forma específica, característica de una
proteína en particular y que a menudo es sumamente
importante para su funcionamiento.
Página siguiente  |



















