- Método del tanteo para balancear
ecuaciones químicas - Balanceo de ecuaciones de
Óxidos - Balanceo de ecuaciones de
Hidróxidos - Balanceo de ecuaciones de
Ácidos

Se sabe que una ecuación se divide
en dos partes: reactivos y productos. Cuando en ambas partes
existe la misma cantidad y clase de átomos entonces la
ecuación esta balanceada, es decir correc – ta o
equilibrada; de tal modo que, balancear una
ecuación es igualar la cantidad de átomos en
los reactivos y productos.
Existen varios métodos para
balancear ecuaciones, unos sencillos y otros
complejos:
1. Método del tanteo. El más
fácil y que se explicara en esta unidad.
2. Método redox (para reacciones de
óxido-reducción).
3. Método algebraico.
4. etc.
Método del
tanteo para balancear ecuaciones químicas
Es llamado también método de
ensayo y error, de inspección, aproximaciones, etc.
Consiste en comparar e igualar la cantidad de átomos de
reactivos y productos de una ecuación desbalanceada,
mediante el uso de coeficientes.
Balanceo de
ecuaciones de Óxidos
Las ecuaciones de Óxidos
básicos y ácidos se balan-
cean de la misma manera, y ambas sustancias
resultan de combinar un no-metal o un metal
tal con el Oxígeno.
Ejemplo 1:

, esta es la ecuación incompleta del
Óxido básico llamado Óxido de
Sodio.
Recuérdese que todas las partes de
una ecuación se pueden dividir en 2 grupos:
símbolos y números. El ejemplo
anterior tiene símbolos pero no números, y
precisamente en esto consiste el balanceo, en
agregarle números a la ecuación, los cuales pueden
ser enteros y grandes (coeficientes) y enteros y
pequeños (sub-índices). Ahora se explica el
balanceo de Óxidos paso a paso.
Primero. Trabaje con los
reactivos: coloque un sub-índice 2 a los elementos
gaseosos. En la tabla periódica, el
color del símbolo de los elementos metales es negro, azul
para los líquidos
y rojo para los gases. Por lo tanto solo al
Oxígeno se le coloca sub-índice 2.
Con el primer paso, la ecuación
anterior queda así (compare)

Segundo. Trabaje con los
productos: coloque la valencia de cada elemento químico en
la parte superior derecha de su
símbolo; intercambie tales valencias,
colocándolas en la parte infe-
rior derecha de cada símbolo (a
manera de sub-índice), y simplifique ambas
valencias, si se pudiese.

Tercero. Realice un conteo de
átomos, tanto en los reactivos como en los productos,
para establecer en que parte de la ecuación
existe la menor cantidad de átomos y en base a esto
rea
lizar los ajustes o verdadero balanceo de
la ecuación.

Obsérvese que en los reactivos hay
un total de 3 átomos, e igual en el producto,
aparentando que la ecuación esta balanceada,
lo cual es falso. Para que la ecuación este balanceada,
deberían de haber 2 átomos de Sodio en
los reactivos tal como los hay en el producto, y dos
átomos de Oxigeno en el producto tal como los
hay en los reactivos. Por esto último, los tres
números de la suma de los reactivos deben ser
iguales a los tres números de la suma del
producto; por lo tanto se continúa con el
balanceo.
Cuarto. Coloque coeficientes,
pudiendo ser solo en los reactivos o bien solo en los
productos, y muchas veces en ambas
partes. El coeficiente se coloca por delante de todo
símbolo o bien
de toda formula; comience con un
coeficiente de valor 2, pudiéndolo cambiar a un valor
mayor si el anterior no resultase. En el ejemplo
presente, se igualara primeramente la cantidad de
átomos de Sodio de los reactivos pues aquí hay una
menor cantidad de ellos, así:

Como puede observarse, ahora los tres
números de la suma de átomos de los reactivos
son iguales a los tres números de la suma de
átomos del producto, lo que indica que tal
ecuación ya está balanceada, la que se
lee así: 4 moléculas de Sodio combinadas con 2
átomos de Oxígeno producen 2
moléculas de Óxido de Sodio. Hay que recordar que
el coeficiente afecta a los sub-índices que
están en una formula (Na2O) o de un símbolo
químico (O2).
Ejemplo 2:

El cuarto paso no se hace en esta
ecuación, pues los tres números de la suma de
átomos de los reactivos son iguales a los
tres números de la suma de átomos del producto, lo
que indica que la ecuación ya está
balanceada, la que se lee así: 1 átomo de Carbono
más 2 átomos de Oxígeno
producen 1 molécula de dióxido de
Carbono.
Balanceo de
ecuaciones de Hidróxidos
Estas sustancias provienen de combinar un
Óxido básico con agua.
Ejemplo 1: se balanceara la
ecuación del Hidróxido de Aluminio.
Primero. Construya la ecuación
incompleta del Hidróxido de Aluminio: de primero se
coloca el Óxido básico, luego una
molécula de agua y por último el producto o
Hidróxido.

Algunas ecuaciones estarán
balanceadas hasta este paso; sin embargo, la mayoría de
ellas necesitaran del próximo paso para
quedar completamente equilibradas.
Observando la ecuación anterior, se
concluye que la misma aún no está balanceada en
este cuarto paso, dado que los 4 valores de la suma
de átomos de los reactivos no son iguales a
los del producto.
Quinto. Coloque coeficientes:
pudiendo ser solo en los reactivos o bien solo en los
productos, o en ambas partes.

Como puede observarse, ahora los cuatro
números de la suma de átomos de los
reactivos son iguales a los cuatro números de
la suma de átomos del producto, lo que indica que
esta ecuación ya está balanceada, la
que se lee así: 1 molécula de Óxido de
Aluminio combinada con 3 moléculas de agua
producen 2 moléculas de Hidróxido de
Aluminio.
Ejemplo 2:

El quinto paso no se hace en esta
ecuación, pues los cuatro números de la suma de
átomos de los reactivos son iguales a los
cuatro números de la suma de átomos del producto,
lo que indica que la ecuación ya está
balanceada, la que se lee así: 1 molécula de
Óxido de Calcio combinada con 1
molécula de agua producen 1 molécula de
Hidróxido de Calcio.
Balanceo de
ecuaciones de Ácidos
Estas sustancias se clasifican en 2 grupos,
cuyo balanceo se explica a continuación por
separado.
a. Hidrácidos.
Existen cinco sustancias de este tipo, que resultan de combinar
el Hidrógeno con los siguientes no-metales:
Flúor, Cloro, Bromo, Iodo y Azufre.
Ejemplo 1: se balanceara la
ecuación del Ácido Fluorhídrico.

Observe que la cantidad de átomos de
Hidrogeno y Flúor es igual en reactivos y
productos.
Ejemplo 2: se balanceara la
ecuación del Ácido Sulfhídrico (Hidrogeno y
Azufre).

El cuarto paso no se realiza en este
ejemplo, pues la cantidad de átomos de Hidrogeno y
Azufre ya es igual en reactivos y producto, es decir, la
ecuación ya está balanceada.
b. Oxácidos. Estas
sustancias resultan de combinar un Óxido ácido con
agua.
Ejemplo 1: se balanceara la
ecuación del Oxácido denominado Ácido
Nítrico.

Como los cuatro números de la suma
de átomos de los reactivos no son iguales a los
cuatro números de la suma de átomos
del producto, entonces la ecuación no está
balanceada, por lo que se continúa con el
último paso.

Como puede observarse, ahora los cuatro
números de la suma de átomos de los
reactivos son iguales a los cuatro números de
la suma de átomos del producto, lo que indica que
esta
ecuación ya está balanceada,
la que se lee así: 1 molécula de pentóxido
de dinitrógeno combinada con 1
molécula de agua producen 2 moléculas de
Ácido Nítrico.
Ejemplo 2: se balanceara la
ecuación del Oxácido denominado Ácido
Carbónico.
Primero. Construya la ecuación
incompleta del Oxácido: de primero se coloca el
Óxido ácido, luego una molécula
de agua y por último se pone el producto u
Oxácido.

Segundo. Coloque las valencias solo a
los elementos del Óxido: intercámbielas
(quedan coMO sub-índices) y
simplifíquelas cuando sea posible; el Oxígeno
actúa con valencia -2 y el
Carbono con valencia +4 (este elemento solo
puede formar un Oxácido)

Tercero. Sume los átomos de cada
elemento de los reactivo, y coloque esos valores en
los mismos elementos del producto, como
sub-índices. Estos se simplifican, si se
pudiese.

Cuarto. Realice un conteo de
átomos, para establecer si se continúa con el
balanceo. Esto se puede realizar mentalmente, es
decir, no hay necesidad de hacerlo por escrito.
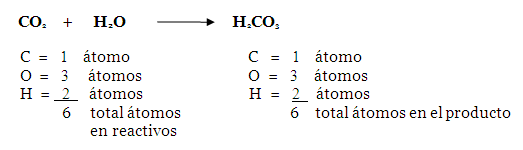
Observando la ecuación anterior, se
concluye que la misma ya está balanceada en este
cuarto paso, dado que los 4 valores de la suma de
átomos de los reactivos son iguales a los del
producto, lo cual se lee así: 1 molécula de
dióxido de carbono combinada con 1
molécula de agua producen 1 molécula
de Ácido Carbónico. Algunas ecuaciones, como la
presente, estarán balanceadas hasta este
paso; sin embargo, la mayoría necesitaran del
próximo paso (colocar coeficientes) para
quedar completamente equilibradas.
BIBLIOGRAFIA
1. de Santos, Verónica Escobar y
Gladys Rodríguez de Vega. Ciencias naturales 3.
Editorial McGraw-Hill. México,
2002.
2. de Rodríguez, Rosa Medina y
María Guadalupe Torres. Química 1. Octava
edición.
Honduras, 2004
3. Del Bosque, Francisco Recio.
Química Inorgánica. Tercera edición.
Mc Graw-Hill.
México, 2005.
4. de Rodríguez, Rosa y Gustavo
Adolfo Zelaya. Folleto Introducción a la
Química. Tercera edición.
Tegucigalpa, Honduras, 1987.
5. Bonnet Romero, Florencia.
Química 1. Segunda edición, Oxford
University Press Harla.
México, S.A. de C.V.
I997.
6. Química general e
inorgánica (Química 10). Editorial Santillana.
Colombia, 1996.
7. Enciclopedia didáctica de
Física y Química. Grupo Océano.
Editorial Océano. España.
8. Seese, William S. y G. William Daub.
Química. Quinta edición. Editorial Prentice
Hall.
México, 1989
Autor:
Jorge A. Marconi
La Ceiba, Honduras, C.A.
Mayo del 2013
