UNIONES ENTRE ÁTOMOS – Monografias.com
- 1.1.1. PRINCIPIO DE
EXCLUSIÓN DE PAULI. - 1.1.2. REGLA DEL
OCTETO. - 1.1.3. PRINCIPIO DE
AUF-BAU. - 1.1.4. CONFIGURACIÓN
ELETRÓNICA.
1.1.1. PRINCIPIO
DE EXCLUSIÓN DE PAULI.
 Los electrones se mueven en la corteza
Los electrones se mueven en la corteza
atómica siguiendo los orbitales, orbitales que vienen
determinados por los números cuánticos principal
(n), azimutal (l) y
magnético (m). Además el
electrón
posee un número cuántico de espín
(s). Determinar los orbitales en los que se
sitúan los electrones de un átomo es lo que se
conoce como configuración electrónica del
átomo.
Wolfgang Ernst Pauli Desarrolló
la teoría del espín electrónico
Conocer la configuración
electrónica es muy importante, ya que de ella dependen
todas las propiedades químicas del elemento en
cuestión. Sus valencias, los compuestos que
formará, su color, su punto de ebullición y
fusión, etc. dependen de su configuración
electrónica.
La configuración electrónica se basa en
unos principios básicos. El primero es el principio de
exclusión de Pauli, según el cual, en un
átomo, nunca puede haber electrones que tengan los cuatro
números cuánticos iguales. Esto limita el
número de electrones que puede haber en cada capa de
la corteza.
CONFIGURACIÓN ELECTRÓNICA
1
UNIONES ENTRE ÁTOMOS

Cada orbital está determinado por los
números cuánticos principal (n),
azimutal (l) y magnético
(m). Como el electrón, además,
tiene dos posibles valores del número cuántico de
espín (s), en cada orbital pueden
colocarse dos electrones, uno con espín
+½ y otro con espín
½.
2 CONFIGURACIÓN
ELECTRÓNICA
UNIONES ENTRE ÁTOMOS

1.1.2. REGLA DEL
OCTETO.
Puesto que por el principio de exclusión
de Pauli no pueden existir dos electrones con los cuatro
números cuánticos iguales, el número de
electrones en cada capa de la corteza está
limitado.
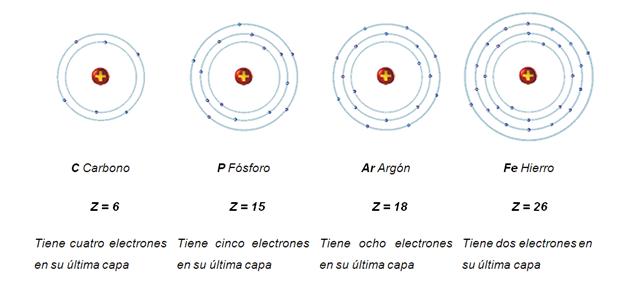
Así, en la primera capa caben 2
electrones, en la tercera 18 y en la
quinta 50. Pero eso no significa que las capas
deban completarse. La regla del octete indica que en la
última capa del átomo sólo puede haber un
máximo de 8 electrones, salvo si es la
primera, que está limitada a 2 electrones.
En la última capa habrá de 1 a 8 electrones (si
hubiera cero, la última capa sería la
anterior).
Si la última capa de electrones es
la quinta, sólo podrá tener en ella un
máximo de 8 electrones, no los 50 que le
cabrían.
En la última capa, sólo puede
haber hasta un máximo de 8 electrones
CONFIGURACIÓN ELECTRÓNICA
3
UNIONES ENTRE ÁTOMOS
1.1.3. PRINCIPIO
DE AUF-BAU.
La disposición de las cosas es siempre de forma
que la energía sea la menor posible. Por eso cuando un
niño sube a un tobogán se desliza hasta el suelo,
en el que la energía es menor, o las pilas se descargan,
perdiendo la energía eléctrica que
almacenaban.
Los electrones se disponen en los orbitales
atómicos también en orden de menor a mayor
energía. Así, los orbitales s de la capa 4 se
llenarán de electrones antes que los d de la capa 3,
aunque estos están más cerca del núcleo, en
una capa inferior.
Conocer la energía de los orbitales es
difícil y cambia de un átomo a otro, sin embargo
hay una regla mnemotécnica, conocida como principio de
Aufbau, en alemán significa constitución, que nos
permite establecer, de forma general, esas
energías.
Principio de Aufbau:La energía de
un orbital será mayor cuanto mayor sea la suma de los
números cuánticos principal n y azimutal l (n + l).
Si la suma es igual, tendrá menor energía el
orbital conmenor número cuántico principal n. El
diagrama de Moeller permite visualizar de forma gráfica y
rápidamente el principio de Aufbau. Consiste en ordenar en
una tabla los orbitales. El orden de energía se obtiene
siguiendo las diagonales de la tabla

4 CONFIGURACIÓN
ELECTRÓNICA
UNIONES ENTRE ÁTOMOS
1.1.4.
CONFIGURACIÓN ELETRÓNICA.
La forma en la que los electrones se disponen en la
corteza del átomo se llama configuración
electrónica. Para determinar la configuración
electrónica hay que indicar la capa, el tipo de orbital y
los electrones que contiene, número éste que se
pone como superíndice. Así, para indicar que los
orbitales d de la capa 4 tienen
5 electrones, se escribirá 4d5
La clase de orbital viene dada por el número
cuánticos azimutal (l). El número
cuántico magnético (m), cuyo valor
varía entre -l y l nos
dirá el número de orbitales de esa clase, en cada
uno de los cuales cabrán dos electrones, dependiendo del
valor del número cuántico de espín
(s).
Los orbitales p son
aquellos en los que l = 1, así que
m puede tomar los
valores -1, 0 o
1 . Hay 3 orbitales
p y podrán admitir 6
electrones.
En los orbitales f, en los
que l = 3, m puede tomar los
valores -3, -2, -1, 0, 1, 2
o 3 . Hay 7
orbitales f y podrán admitir
14 electrones:
Orbitales s p d f g
Electrones 2 6 10 14 18
CONFIGURACIÓN ELECTRÓNICA
5
UNIONES ENTRE ÁTOMOS
Si un átomo tiene 32 electrones,
siguiendo el principio de Aufbau, se distribuirán en los
orbitales:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d
…
Recordando los electrones que caben en cada orbital, y
contando hasta 32, la configuración
electrónica será:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p2

El diagrama de Moeller es necesario para determinar la
configuración electrónica.
En los orbitales 4p sólo se han
colocado 2 electrones (recuerda que el
número de electrones es el superíndice), para no
superar 32, que es el número total de
electrones.
De igual forma se puede determinar la
configuración electrónica del
oxígeno,
con 8 electrones, que
quedará:
1s2 2s2 2p4
O del hierro, con 26, que
resultará:
1s2 2s2 2p6 3s2 3p6 4s2 3d6
6 CONFIGURACIÓN
ELECTRÓNICA
