- Conceptos e importancia
- Representación de las reacciones
químicas - Clasificación de las reacciones
químicas (tipos) - La
energía de las reacciones - Velocidad de reacción
- Bibliografía
Conceptos e
importancia
La materia puede sufrir cambios
físicos, químicos y nucleares. Los cambios
químicos suceden mediante las reacciones
químicas, y estas se representan mediante las
ecuaciones químicas.
Las reacciones químicas suceden a
cada segundo y en todo el universo. Las mismas tienen di- versas
importancias y pueden ser de diferentes tipos; estas reacciones
suceden en el aire, en el suelo, en los vegetales, en los
animales, en los humanos, en la cocina, en automóviles,
etc. Son ejemplos de reacciones químicas la
respiración, la fotosíntesis, el metabolismo, la
reproducción, el crecimiento, la formación de
óxidos, de hidróxidos, de ácidos, de sales,
de rocas y suelo, etc.
Sin embargo, para que se realice una
reacción química es necesaria la presencia de una o
más sustancias, para que se descomponga o se combinen y
así formar las o la nueva sustancia.
– Conceptos de reacción
química.

* Son los cambios, reacomodos o
reorganizaciones que sufren los átomos de las
sustancias o elementos que se combinan para producir
nuevas sustancias.
* Es el rompimiento de viejos enlaces
químicos para formar nuevos enlaces, y así nuevas
sustancias.
* Es el proceso mediante el cual una o
más sustancias combinadas se transforman en otra u otras,
con propiedades diferentes.
* Proceso en el que a partir de una o mas
sustancias se originan otras nuevas.
– Importancia de las reacciones
químicas.

Hablar de reacciones químicas es
hablar de cambios, los cuales suceden a cada momento y en todas
partes, por lo que su estudio es de vital importancia. Entre las
importancias están:
* Mediante ellas se producen nuevos
compuestos, como medicinas.
* Los seres se mantienen vivos gracias a
ellas, es el caso de la digestión, la fotosíntesis
y la respiración.
* En el medio ambiente ocurre la
combustión (el fuego para diversos usos).
Representación
de las reacciones químicas
En realidad, las reacciones químicas
no se pueden ver a simple vista, es decir, el hombre no puede ver
los cambios que suceden al momento de combinar dos o más
sustancias, pero si sabe lo que sucede, y, por lo tanto, puede
escribir tales cambios mediante una ecuación
química.
Una ecuación química es " la
representación gráfica (por escrito) de una
reacción química", es decir, las
reacciones químicas se representan por medio de las
ecuaciones químicas, mismas que están
formadas por varias partes, las que se agrupar de dos
maneras:
a. Reactivos y
productos. Las sustancias que se combinan se llaman
reactivos, y se localizan a la izquierda de la
ecuación; y a las sustancias que resultan de tal
combinación se les nom –
bra productos(sustancias nuevas),
localizadas a la derecha de la ecuación. Por ejemplo,
cuando el Hidrogeno se combina con
Oxigeno(reactivos) reaccionan y originan una nueva
sustan
cia llamada agua (producto);esta
reacción química se puede representar mediante una
ecuación química denominada
ecuación del agua, así:
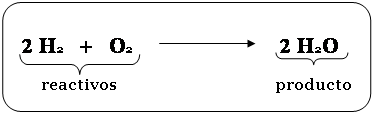
Observe que los reactivos siempre se
colocan a la izquierda de la flecha (que significa "se
origina o produce"), y los productos a la derecha de
la misma. Otro ejemplo de ecuación es la del
óxido de magnesio:

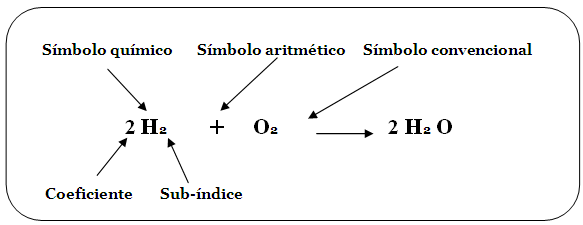
b. Símbolos y
números. Otra manera de dividir a las partes de una
ecuación es en símbolos
y números. En una ecuación
existen tres tipos de símbolos:

En cuanto a los números,
existen dos tipos de ellos en una ecuación:
– Enteros y grandes, llamados
coeficientes.
– Enteros y pequeños, llamados
sub-índices.
El coeficiente es el número grande
que va situado por delante de todos los símbolos de
una formula, e indica la cantidad de
moléculas de la sustancia de que se trate; cuando no
aparece
un coeficiente en la fórmula es
porque se supone que es uno (1), el cual no se escribe, lo
que también se aplica para el
sub-índice. Cuando el coeficiente se multiplica por el
sub-índice resulta el total de átomos del elemento
químico que lo lleva en la formula, esto es que, el
coeficiente afecta a todos los sub-índices de una
formula.
Respecto al sub-índice, este es un
número pequeño que se localiza en la parte inferior
derecha de cada símbolo químico e que
indica la cantidad de átomos del elemento. Así
mismo,
cuando en el símbolo químico
no aparece el sub-índice es porque se supone que es
uno(1), el cual no se escribe. Observe los
símbolos y números en la siguiente ecuación
del agua:

a. La o las nuevas sustancias que se forman
(productos) suelen presentar un aspecto
totalmente diferente del que
tenían las sustancias originales (reactivos).
b. Durante las reacciones se desprende
o se absorbe energía, por lo que estas pueden
dividirse en exotérmicas (desprenden
energía en el curso de la reacción), y
endotérmicas (absorben e-
nergía durante el curso de la
reacción).
c. Se cumple la ley de conservación
de la masa: "la suma de las masas de los reactivos es igual
a la suma de las masas de los productos". Esto es
así porque durante la reacción los átomos
ni aparecen ni desaparecen, sólo se reordenan
para formar las nuevas sustancias.
d. Las reacciones alteran la estructura
interna de los reactivos.
Clasificación
de las reacciones químicas (tipos)
Todas las reacciones químicas
existentes se pueden clasificar de diversas maneras, por ejemplo,
algunos autores las clasifican en dos grandes grupos: reacciones
de neutralización (acido -base) y reacciones de
oxidación-reducción (redox); otros autores las
clasifican en un solo grupo como reacciones generales, y
así existen otras clasificaciones. He aquí todos
estos grupos de re –acciones:
a. Reacciones de energía. Estas son
de dos tipos:
– Reacciones exotérmicas. Son
aquellas que liberan o pierden calor, por ejemplo las reacciones
de combustión, que por desprender energía se
utilizan como fuente de esta. En la combustión los
reactivos son el combustible y el oxígeno del aire, y los
productos suelen ser, aunque no siempre, dióxido de
carbono y vapor de agua. Ejemplos:
Otros ejemplos de reacciones que desprenden
energía o calor son: el paso de gas a
líquido (condensación) y el paso de
líquido a solido (solidificación).
– Reacciones endotérmicas.
Estas reacciones necesitan calor para que se lleven a cabo.
En ellas los productos tienen más
energía que los reactivos. Un ejemplo de reacción
endotérmica es la producción del ozono (O3). Esta
reacción ocurre en las capas altas de la atmósfera,
en donde las radiaciones ultravioleta proveen la energía
del Sol. También ocurre cerca de descargas
eléctricas (cuando se producen tormentas
eléctricas). Hornear pan, calentar una tortilla y hervir
agua requieren de energía (calor).
b. Reacciones de proceso. Que pueden ser de
dos tipos:
– Reacciones reversibles. Son aquellas en
donde los productos que se forman pueden regresar a
sus estados o sustancias originales (reactivos). Este concepto
está plasmado en aquellas ecuaciones que presentan dos
flechas en sentido opuesto.
– Reacciones irreversibles. Los productos
que se forman no pueden volver a sus estados o sustancias
originales.
c. Reacciones de velocidad. Se clasifican
en:
– Reacciones rápidas. En estas se
forma una elevada cantidad de producto, en relación al
tiempo en que se realizó la reacción.
– Reacciones lentas. La cantidad de
producto formado es muy pequeña, siempre en
relación al tiempo.
d. Reacciones REDOX. Son aquellas en las
que algunos elementos químicos cambian su número de
oxidación. Dicho de otro modo, una de las sustancias a
combinar perderá o cederá electrones y la otra
sustancia a combinar los ganara o aceptara tales electrones. Por
lo tanto, estas reacciones son de dos tipos:

e. Reacciones de enlace.
– Reacciones iónicas. En la
combinación de sustancias hay ganancia y pérdida de
electrones.
– Reacciones covalentes. Las sustancias
combinadas comparten sus electrones.
f. Reacciones generales. Es la
clasificación más utilizada, y pueden
ser:
– Reacciones de síntesis o
combinación. Es cuando dos o más elementos y/o
sustancias se
combinan para formar una nueva sustancia y
más compleja.
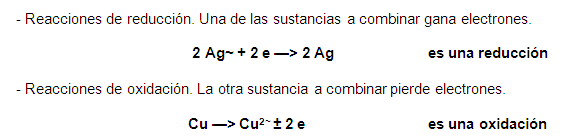
– Reacciones de
descomposición. Una sustancia compleja se descompone
en las sustancias simples que la forman.
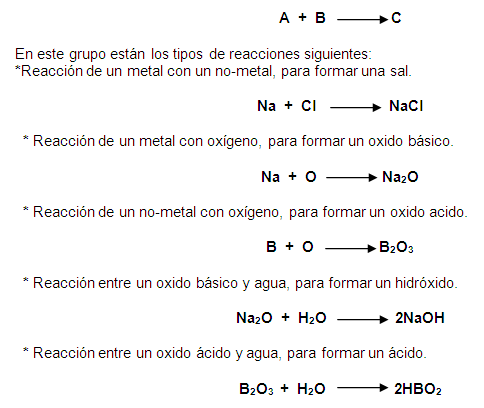
– Reacciones de desplazamiento
sencillo. Una sustancia simple reacciona con una sustantancia
compleja, provocando en esta la separación de uno de sus
componentes. En otras palabras, un elemento químico libre
sustituye a otro que está formando parte de un
compuesto.

– Reacciones de doble
desplazamiento. Dos sustancias compuestas o complejas
reaccionan entre si, provocándose la
separación e intercambio de alguno de sus componentes. Es
decir,
dos sustancias complejas intercambian
elementos químicos.
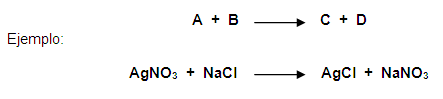
Cuadro resumen de las reacciones
químicas generales.
Nombre | Descripción | Representación | ||
Reacción de | Elementos o compuestos | A+B ? AB | ||
Reacción de | Un compuesto se fragmenta en | AB ? A+B | ||
Reacción de | Un elemento reemplaza a otro | A + BC ? AB + | ||
Reacción de doble | Los iones en un compuesto | AB + CD ? BC + | ||
La energía de
las reacciones
El hombre ha utilizado las reacciones
químicas para producir energía; por ejemplo,
utiliza la combustión de madera o de carbón,
invento los motores de explosión de los coches, llegando
hasta las más sofisticadas, que tienen lugar en los
motores de propulsión de las naves espaciales.

Figura 1
Se sabe que las
reacciones químicas van acompañadas en unos casos
de un desprendimiento de energía, y en otros de una
absorción de la misma. En el primer caso se denominan
reacciones exotérmicas y en el segundo caso reacciones
endotérmicas; así, las reacciones implican un
intercambio de energía con su medio. La energía de
cualquier sustancia química está formada por su
energía cinética y potencial, y es – tas
están localizadas en sus partículas constituyentes:
átomos, electrones y núcleos. Por tanto, se puede
afirmar que los reactivos de una re acción química
poseen cierta cantidad de energía propia (energía
in – terna), y que los productos poseen otra cantidad
diferente.

Figura 2
La energía desprendida o absorbida
puede ser en forma de energía luminosa, eléctrica,
etc., pero habitualmente se manifiesta en forma de calor, por lo
que el calor desprendido o absorbido en una reacción
química se llama calor de reacción y tiene
un valor característico para cada reacción, en unas
determinadas condiciones de presión y
temperatura.
Para llevarse a cabo, muchas reacciones
químicas absorben energía de la luz solar como es
el caso de la fotosíntesis, que es catalogada como una
reacción endotérmica. En general, si el lugar donde
se lleva a cabo una reacción química esta frio,
luego esta reacción absorbió la energía del
medio; si por el contra rio el lugar está caliente,
entonces la reacción desprendió calor.

Figura 3
Velocidad de
reacción
En la mayoría de los casos interesa
acelerar las reacciones químicas, como por ejemplo en la
fabricación de productos, en la curación de heridas
o enfermedades, en la maduración de los frutos, en el
crecimiento de las plantas, etc. Pero existen casos en que
interesa retardar las reacciones químicas, para el
caso,
la corrosión de los materiales de
hierro y otros metales, en la descomposición de alimentos,
en el retraso de la caída del cabello y de la vejez,
etc.
Las industrias se interesan grandemente en
que las reacciones químicas se lleven a cabo
rápidamente, para así ahorrar tiempo y dinero. La
Química estudia este aspecto, el de la velocidad de las
reacciones, mediante una de sus ramas llamada cinética
química.
Una reacción química necesita
tiempo para que se lleve a cabo. Cuando se combinan 2 o
más sustancias, estas pueden reaccionar en forma
rápida o lenta para formar los productos o las sustancias
nuevas, por lo cual las reacciones se dividen también en
reacciones rápidas y reacciones lentas. En base a lo
anterior, surge el término de tiempo de
reacción, que se define como el tiempo en el que
transcurre una reacción química.
La velocidad de una misma reacción
química varia conforme avanza el tiempo, es decir, la ve
locidad no es constante, no es la misma durante se lleva a cabo
la reacción. Ahora bien, si relacionamos el tiempo de la
reacción con las cantidades de los reactivos y productos,
entonces resulta un nuevo concepto: el de velocidad de
reacción, el que se define de las maneras
siguientes:
– Es la velocidad a la que se forman los
productos en una reacción química.
– Es la velocidad a la que se gastan los
reactivos en una reacción química.
– Es la cantidad de una sustancia que se
transforma en una reacción química en la unidad de
tiempo.
Lo anterior significa que, en una
reacción química una cierta cantidad de reactivos
produce otra cierta cantidad de productos en menor o mayor
tiempo, lo cual depende de la velocidad con que se lleve a cabo
la reacción. La reacción se califica de
rápida cuando los reactivos se gastan o consumen en menos
tiempo, o bien cuando los productos se forman de
prisa.
Son ejemplos de reacciones rápidas y
lentas las siguientes:
– Un trozo de carne se descompone
rápidamente a temperatura ambiente, y lentamente en la
refrigeradora.
– Los materiales de hierro se oxidan
más rápido que los materiales de
aluminio.
– La formación de agua es más
rápida que la del petróleo.
– Ocurre más rápido la
formación de óxido de sodio (Na2O) que la de
óxido de hierro (Fe2O3).
– La combustión de un pedazo de
papel sucede más rápido que la digestión
humana.
Científicamente se ha demostrado que
una reacción, ya sea rápida o lenta (velocidad de
reacción), se ve afectada o depende de cuatro situaciones:
la naturaleza de los reactivos, concentración de los
reactivos, la temperatura y de la presencia de
catalizadores.
– Naturaleza de los
reactivos.
Esto se refiere a la capacidad que tiene
una sustancia para combinarse con otra y así formar nuevas
sustancias, o bien, a la facilidad con que una sustancia se
descompone en otras más simples. Las sustancias gaseosas
reaccionan más rápido que los liquidos y los
sólidos, en este orden. Así mismo, las sustancias
que presentan enlaces iónicos reaccionan más
rápido que aquellas que presentan enlaces
covalentes.
Las reacciones iónicas se
efectúan inmediatamente, debido a las frecuentes
colisiones entre los iones con cargas opuestas.
– Concentración de los
reactivos.
Se entiende por concentración a la
cantidad de sustancia existente en un determinado volumen. Por
ejemplo, en un litro de agua existen 2 gramos de azúcar de
mesa, y en otro litro de agua existen 50 gramos de la misma
sustancia; en este último caso la concentración de
azúcar es mayor, pues hay una mayor cantidad de esta
sustancia por litro de agua (volumen). En muchas reacciones, las
distintas sustancias que intervienen (reactivos y productos)
suelen formar una mezcla homogénea, cuya cantidad se puede
medir en unidades de nominadas mol.
En la mayoría de los casos una
reacción química aumenta su rapidez al
incrementarse la concentración de uno o más de sus
reactivos. Al aumentar la concentración de un reactivo
aumenta también el número de sus partículas
(moléculas) en el medio de la reacción. La
velocidad es mayor al comienzo de la reacción, pues hay
una mayor concentración de reactivos, pero cuando estos
disminuyen con el tiempo entonces disminuye la velocidad de
reacción; por lo tanto, a mayor concentración de
los reactivos se mejora la rapidez de la
reacción.
"La velocidad de una reacción
química es proporcional a la concentración en moles
por litro (moles/litro), de las sustancias reaccionantes". Esto
significa que, si duplicamos la concentra – ción de los
reactivos entonces la velocidad de la reacción se duplica.
Así mismo, al aumentar la presión en dos sustancias
gaseosas que van a reaccionar entonces se aumenta su
concentración y por lo tanto se aumenta la velocidad de
reacción.
– Temperatura.
Se dice que "la velocidad de una
reacción crece, en general, con la temperatura y se
duplica, aproximadamente, por cada 10 °C que aumenta la
temperatura". En forma breve, al incrementarse la temperatura
se aumenta la velocidad de las reacciones
químicas.

Figura 4
Por ejemplo, el cloruro de sodio reacciona
lentamente con el ácido sulfúrico; si se le
proporciona calor aumenta la velocidad de reacción dando
sulfato de sodio (Na2SO4) y ácido
clorhídrico:

Otro ejemplo, el hidrógeno y el
oxígeno pueden mantenerse durante años en el mismo
recipien te sin reaccionar. Pero si la mezcla se calienta a 800
°C, o se introduce una llama o una chispa en el recipiente,
el hidrógeno y el oxígeno reaccionan violentamente.
Esto es que, la temperatura au menta el movimiento (velocidad) de
las moléculas de estas dos sustancias, y por lo tanto
aumen- ta el choque continuo entre ellas, o sea, aumentan las
colisiones, lo que hace que los reactivos se rompan o se
descompongan para luego recombinarse, y de esta manera formar las
nuevas sustancias llamadas productos.
Ahora bien, el efecto de la temperatura
sobre una reacción es mucho mayor a temperatura baja que a
temperatura alta. Para el caso, si a las reacciones
exotérmicas se les eleva su temperatura entonces se
desmejora el equilibro químico de estas reacciones, hasta
incluso se puede detener tal reacción. Sin embargo, en las
reacciones endotérmicas aumentar la temperatura favorece a
la reacción. En conclusión, el incremento en la
temperatura favorece a las reacciones endotérmicas y no a
las exotérmicas.
– Presencia de
catalizadores.
Un catalizador es una sustancia que
modifica la rapidez de una
reacción química sin que ella
misma se consuma en el proceso o sufra algún cambio
químico. Otra definición es: los catalizadores son
sustancias que, añadidas en pequeña cantidad,
modifican la velocidad de una reacción sin experimentar
ningún cambio y sin que se modifique la cantidad de
producto formado. En pocas palabras, un catalizador es una
sustancia que acelera o retarda una reacción
química.
Los catalizadores que aceleran las
reacciones se denominan catalizadores positivos, y los que las
retardan se llaman catalizadores negativos. En ninguno de los dos
casos los catalizadores se modifican o sufren cambios, y el
proceso se nombra como catálisis. Los
catalizadores solo ayudan a que la reacción se lleve a
cabo con mayor o menor rapidez; sin embargo, las reacciones
químicas pueden ocurrir sin la presencia de
catalizadores.
Los catalizadores pueden ser de origen
orgánico e inorgánico; en el primer caso
están las enzimas y los ribosomas (ácidos
ribonucleicos), y en el segundo caso están el platino,
níquel, cobalto, cobre, etc.
Bibliografía
1.
www.rena.edu.ve/…/Química/ReaccionesQuimicas.html
2. Seese et al. Química. Octava
edición. Editorial Pearson-Prentice Hall. México,
2005.
3.
es.wikipedia.org/wiki/Cinética química
–
4.
www.ejemplode.com/…química/606-la_energia_y_las_reacciones_quimicas.html
–
5.
www.fisicanet.com.ar/quimica/…/ap01_reacciones_quimicas.php
–
6-
espanol.answers.yahoo.com/question/index?qid… –
7.
www.fisicanet.com.ar/…/q1_cinetica_quimica.php.
IMÁGENES O
FIGURAS
1. espacioreal.blogspot.com
2. santocaos.blogspot.com
3. lamochila.espectador.com
4. alienonstrike.blogspot.com
Enviado por:
Jorge A. Marconi
La Ceiba, Honduras, C.A
Agosto del 2013
