- Introducción
- Concepciones
Filosóficas - Teoría atómica de
Dalton - Modelo
atómico de Thomson - Modelo
atómico de Rutherford - Modelo
atómico de Bohr - Teoría atómica
moderna - Conclusión
- Bibliografía
Introducción
El siguiente trabajo es una pequeña
introducción sobre lo que estudia química y como
también física, de la teoría atómica,
de cómo surge sus investigaciones sobre ello de
filósofos, científicos y químicos que unen
todos sus criterios para llegar a una conclusión del
estudio del mismo.
Las funciones que posee el átomo y sobre la
influencia que tiene en la sociedad. Por qué tanto nos
ayuda en lo bueno y en lo malo como por ejemplo: en la
creación de paneles solares, centrales nucleares y lo malo
con la creación de bombas atómicas que destruyen
nuestro alrededor y nuestro medio ambiente, por eso estamos como
estamos.
Concepciones
Filosóficas
El concepto atómico de la materia surgió
aproximadamente hace 450 años a.c., cuando el
filósofo griego Leucipo afirmaba que la materia es
discontinua porque estaría formada por partículas
discretas indivisibles llamadas átomos (en griego
"átomo" significa indivisible), que sería el
límite de división de la materia.
Demócrito (380 años a.c.),
discípulo de Leucipo, sostenía que el elemento
último de la realidad es el átomo, partícula
eterna, indivisible, invisible y homogénea.
Muchos filósofos clásicos griegos
consideraban absurda esta teoría atómica y la
rechazaban; entre ellos tenemos a Empédocles,
contemporáneo de Demócrito, quien sostenía
que todos los materiales están compuestos por cuatro
"elementos": tierra, aire, fuego y agua;
Aristóteles (300 años a.c.), discípulo de
Empédocles, describió los 4 elementos como la
combinación de propiedades fundamentales de la materia:
sequedad, humedad, calor y frio, así:
Las doctrinas del atomismo se perpetuaron por medio del
poema De Rerum Natura, escrito alrededor del año 50 a.c.
por el poeta romano Lucrecio.
Unos veinte siglos después (1661),
el físico y químico ingles Robert Boyle en su libro
"el Químico Escéptico", acepto la existencia del
átomo; Isaac Newton, en su obra "Principia" (1867) y
"Ópita" (1704), también acepto la teoría
atomista de la materia.
Teoría
atómica de Dalton
Las leyes ponderales de las combinaciones
químicas encontraron una explicación satisfactoria
en la teoría atómica formulada por DALTON en 1803 y
publicada en 1808. Dalton reinterpreta las leyes ponderales
basándose en el concepto de átomo. Establece los
siguientes postulados o hipótesis, partiendo de la idea de
que la materia es discontinua:
Los elementos están constituidos por
átomos consistentes en partículas materiales
separadas e indestructibles;
Los átomos de un mismo elemento son iguales
en masa y en todas las demás cualidades.
Los átomos de los distintos elementos tienen
diferentes masas y propiedades
Los compuestos se forman por la unión de
átomos de los correspondientes elementos en una
relación numérica sencilla. Los
«átomos» de un determinado compuesto son a su
vez idénticos en masa y en todas sus otras
propiedades.

Aunque el químico irlandés HIGGINS, en
1789, había sido el primero en aplicar la hipótesis
atómica a las reacciones químicas, es Dalton quien
le comunica una base más sólida al asociar a los
átomos la idea de masa.
Los átomos de DALTON difieren de los
átomos imaginados por los filósofos griegos, los
cuales los suponían formados por la misma materia
primordial aunque difiriendo en forma y tamaño. La
hipótesis atómica de los antiguos era una doctrina
filosófica aceptada en sus especulaciones
científicas por hombres como GALILEO, BOYLE, NEWTON, etc.,
pero no fue hasta DALTON en que constituye una verdadera
teoría científica mediante la cual podían
explicarse y coordinarse cuantitativamente los fenómenos
observados y las leyes de las combinaciones
químicas.
La teoría atómica constituyó tan
sólo inicialmente una hipótesis de trabajo, muy
fecunda en el desarrollo posterior de la Química, pues no
fue hasta finales del siglo XIX en que fue universalmente
aceptada al conocerse pruebas físicas concluyentes de la
existencia real de los átomos. Pero fue entonces cuando se
llegó a la conclusión de que los átomos eran
entidades complejas formadas por partículas más
sencillas y que los átomos de un mismo elemento
tenían en muchísimos casos masa distinta. Estas
modificaciones sorprendentes de las ideas de DALTON acerca de la
naturaleza de los átomos no invalidan en el campo de la
Química los resultados brillantes de la teoría
atómica.
Modelo
atómico de Thomson
Thomson y el electrón:
A finales del siglo XIX, los científicos
empezaron a notar comportamientos en la materia que no se
podían explicar mediante el modelo atómico
propuesto por Dalton, como por ejemplo el experimento realizado
por Millikan a mediados del siglo XIX, el cuál
consistió en dejar caer una gota de aceite a través
de un campo eléctrico en un tubo cerrado al vacío,
el cuál determinó que la carga mínima que
adquiría la gota de aceite era igual a 1,6×10-19 C, la que
junto a otras experiencias de carácter
electromagnético daban la idea de que el modelo
"esférico indivisible" propuesto por Dalton estaba errado
y que había alguna partícula cargada que pudiera
ser afectada por cambios en el campo eléctrico.
Tras estos descubrimientos, los científicos
empezaron a tratar de darle una explicación a estos
fenómenos.
La más importante fue la realizada por Thomson a
finales del siglo XIX e inicios del XX, la cual consistió
en la utilización de un tubo llamado "tubo de rayos
catódicos" (Imagen 2), el cual consistía en dos
electrodos unidos a una fuente de alto voltaje, conectados en un
tubo cerrado al vacío. Al hacer pasar corriente
eléctrica desde la fuente de poder al ánodo
(electrodo negativo) se veía que un haz luminoso se
dirigía desde el ánodo hacia el cátodo
(electrodo positivo).
Imagen 2: Tubo de rayos catódicos

A este rayo se le llamó rayo
catódico y fue el estudiado por Thomson, el
cuál sometió a este rayo a un campo
electromagnético, observando que el rayo se desviaba de su
línea recta hacia el extremo positivo del campo, lo que
sumado al conocimiento de que cargas opuestas se atraen le dio
como conclusión que el rayo catódico estaba
compuesto por partículas negativas provenientes del
ánodo, a las cuales les llamó
electrones.
Tras este descubrimiento, Thomson formuló un
nuevo modelo atómico que fue denominado "pastel de
pasas" (representado aproximadamente en la Imágen 3),
el cuál consistía en que los electrones se
encontraban incrustados en una esfera cargada positivamente con
la misma intensidad de carga (ésta fue la primera vez que
se propuso la electro-neutralidad del átomo),
además Thomson pudo establecer que la razón entre
carga del electrón (que fue descubierta por Millikan,
explicado anteriormente) y su masa era igual a
1,756×108.
Imagen 3: Las pelotitas blancas representan
a los electrones y la pelota roja representa la partícula
positiva.

Modelo
atómico de Rutherford
En 1910, Ernest Rutherford, un físico
neozelandés, quiso poner a prueba el modelo atómico
postulado por Sir Joseph Thomson, el cual consistió en que
hacer pasar un rayo de partículas alfa (partículas
cargadas positivamente) a través de una lámina de
oro extremadamente delgada. Este experimento se muestra de una
manera muy sencilla en la Imagen 4. Los resultados obtenidos,
llevaron a Rutherford a plantear su propio modelo atómico,
el cual se muestra en la Imagen 5. Las principales conclusiones
que se obtuvieron fueron:
El átomo es mayormente vacío, lo que
explicaría el porque la mayoría de las
partículas atravesaron la lámina de oro sin sufrir
desviación.
El átomo posee un centro denso, que abarca la
totalidad de la masa. Además, este centro, llamado
núcleo, está cargado positivamente, razón
por la cual, las partículas alfa al acercarse a él
sufrían desviaciones (cargas iguales se
repelen).
Debido a que el átomo es eléctricamente
neutro, los electrones deben estar rodeando al núcleo,
girando en órbitas circulares alrededor de él, tal
y como lo hacen los planetas alrededor del Sol. La cantidad de
electrones es igual y de signo contrario a la carga ubicada en el
núcleo.
Ahora, bien, ¿por qué no era válido
el modelo del "pastel de pasas" para explicar los resultados
obtenidos? La respuesta está en que el modelo que
regía hasta ese entonces consideraba al átomo como
una esfera compacta, dentro de la cual tenía incrustados a
los electrones. Si ese modelo hubiese sido correcto, las
partículas alfa tendrían que haber rebotado en la
lámina de oro, ya que ocurriría el mismo efecto de
cuando uno hacer chocar dos bolitas, pero el hecho de que la
mayoría atravesara la lámina de oro, indica que esa
concepción atómica estaba errada.

Imagen 4: Experimento de la lámina
de oro

Imagen 5: Modelo atómico
Planetario de Rutherford
En 1886, Eugen Goldstein descubrió
que si se le hacían agujeros al ánodo de un tubo de
rayos catódicos, era posible ver otras emanaciones que se
dirigían desde el cátodo hacía en
ánodo, cuando se hacía pasar una corriente
eléctrica. Descubrió que estos rayos (a los que
llamó rayos canales) tenían carga positiva y que su
masa dependía del gas que estuviera en el tubo. A estas
cargas se les denominó protones. Como estas
partículas están cargadas con el mismo signo,
debiesen repelerse, pero están todas colocadas en el
núcleo, entonces ¿cómo es esto posible?
Rutherford pensó que debiese existir otra
partícula que sirviera de "pegamento" que mantuviera
estable el núcleo.
Al inicio de la década de 1930, James Chadwick,
quien fuese alumno de Rutherford, descubrió la presencia
de una partícula sin carga, de masa aproximadamente igual
a la del protón, la cúal fue llamada
neutrón, comprobando la hipótesis de su
profesor sobre la existencia de dicha
partícula.
Modelo
atómico de Bohr
El modelo atómico planteado por Rutherford
tenía ciertas falencias que hacían dudar de su
veracidad, como por ejemplo, que, según la física
clásica, un cuerpo con carga en movimiento
liberaría energía, por lo cual el electrón
iría perdiendo energía en su movimiento circular
alrededor del núcleo, lo que conllevaría a que, en
un determinado momento, la fuerza de atracción
electrostática entre el núcleo y el electrón
provocaría que éste último se precipitara
contra el núcleo destruyendo el átomo.
Para solucionar este problema, Niels Bohr, aplico la
teoría cuántica de Max Planck, la cual decía
que la energía estaba "cuantizada", es decir, que
absorbía o liberaba pequeños paquetes de
energía, llamados cuantos, al modelo planetario de
Rutherford, generando un nuevo modelo atómico, denominado
modelo atómico estacionario, el cual decía
que:
La energía del electrón está
cuantizada.
El electrón se mueve alrededor del núcleo
en un nivel de energía estacionario, en donde, mientras se
encuentre en él, no perderá ni ganará
energía. Este nivel se encontrará lo más
cercano al núcleo que le sea posible.
Cuando un electrón gana energía, salta del
nivel estacionario a un nivel de mayor energía. Cuando el
electrón vuelva a su nivel basal o estacionario
liberará la energía sobrante en forma de
luz.
Las órbitas donde se encuentran los electrones
son circulares.
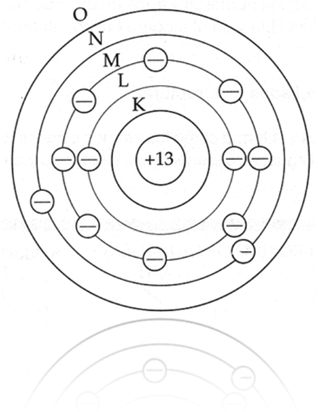
Bohr definió las órbitas con letras que
iban desde la K en adelante, siendo K la órbita de menor
energía, tal y como lo muestra la Imagen 6.
Lamentablemente este modelo solo sirvió para los
átomos del tipo hidrogenoides, siendo muy deficiente para
los átomos poli electrónicos (solo pudo determinar
la cantidad máxima de electrones por nivel con la
fórmula 2n^2 [considerando que K = 1, L = 2, M = 3 y N =
4.]).
Imagen 6: Modelo de Bohr
Teoría
atómica moderna

Toda materia del Universo está formada por
pequeñas partículas llamadas átomos. Son muy
pequeñas, tanto que es imposible verlas ni fotografiarlas.
Para que te des una idea de su tamaño, en un punto de la
pantalla de tu computadora podrían caber aproximadamente
dos mil millones de átomos.
La teoría atómica moderna es muy compleja
y difícil de entender para quien no conoce los conceptos
básicos de química y física. La
química es la rama de la ciencia encargada de su estudio,
aunque en algunos aspectos del comportamiento de los
átomos interviene la física. La teoría
atómica moderna ha tardado más de un cuarto de
siglo en llegar a ser lo que es hoy en día: una
herramienta muy valiosa para todo tipo de
aplicaciones.
Gracias a la teoría atómica es posible la
construcción de centrales nucleares, que aunque no
son del todo ecológicas, significan una alternativa para
la obtención de energía eléctrica mucho
más viable en relación a otros métodos de
obtención.
Desgraciadamente, también se ha usado esta
tecnología para fabricar bombas atómicas, y
lo peor de todo no es que estas bombas existan en los
depósitos militares, sino que ya se han usado en la guerra
o en pruebas nucleares, con los resultados desastrosos que todos
conocemos.
Básicamente la teoría atómica
moderna utiliza ciertos isótopos que son
átomos con diferencias de neutrones en los núcleos
atómicos. Esto los transforma en elementos inestables, y
se puede obtener una inmensa energía a partir de ellos
cuando se transforman en átomos estables.
La tecnología atómica es
importantísima para la ciencia y significa un gran avance
de la humanidad. Las implicaciones que ha tenido la teoría
atómica, tanto para la ciencia como para las aplicaciones
que ha facilitado, la transforman en una de las teorías
más importantes en toda la historia de la
ciencia.
Conclusión
Ya realizado el trabajo nos dimos cuenta de la
evolución de las teorías de la atómica o
átomo que surgen hasta la teoría atómica
moderna, ya que fueron muchos estudios para comprender sobre la
función del átomo y sus propiedades.
Ya que fue un avance muy provechoso que nos facilita en
la producción energía eléctrica y otros,
pero también tiene su lado opuesto como ya dicho de la
creación de bombas atómicas que destruyen nuestro
medio.
Bibliografía
http://www.buenastareas.com/ensayos/Concepciones-Filosoficas/7398850.html
http://encina.pntic.mec.es/~jsaf0002/p32.htm#Teoría
atómica de Dalton
http://es-puraquimica.weebly.com/thomson.html
http://es-puraquimica.weebly.com/rutherford.html
http://es-puraquimica.weebly.com/bohr.html
http://www.ojocientifico.com/2011/04/29/teoria-atomica-moderna
Autor:
Ventura Ralac
