Introducción
La tabla periódica es un instrumento muy
importante y familiar para nuestras vidas que forma parte del
material didáctico para cualquier estudiante y estudiante
de la química, medicina e ingeniería. En la tabla
periódica se obtienen datos necesarios de algún
elemento determinado, conoceremos la historia de la tabla
periódica, de quienes fueron los químicos en
construir la tabla periódica que hoy conocemos y
cuáles fueron las primeras clasificación de los
elementos, como el descubrimiento de los elementos de la tabla
periódica y la noción de cada elemento y las
propiedades periódicas ya que cada elemento tiene casi la
misma propiedad química, pero no se utilizan para la misma
tarea, también se explicara sobre que es un peso
atómico y quien fue el descubridor de la misma, ya que
cada elemento de la tabla periódica posee diferente peso
atómico.
Ahora en nuestra actualidad la tabla periódica ya
no posee la misma organización de elementos como antes,
ahora ya se dividen en grupos las cuales son las columnas que
observamos en alguna tabla periódica las cuales son 18
grupos y cada grupo le corresponde un nombre que caracteriza a
todos los integrantes del mismo, como también están
divididos en periodos las cuales son las filas que observamos en
la tabla periódica y que son 7 periodos, pero sucede que
el periodo 6 y 7 se une a la última tabla que se encuentra
debajo de la otra tabla más grande la cual forma un total
de 7 periodos y cada periódico se caracteriza
que cada elemento está ordenado de forma que aquellos
con propiedades químicas semejantes, se encuentren
situados cerca uno de otro, pues conoceremos todo esta
información adentrándonos a la lectura del
siguiente tema la cual se detalló los más
importante que encontraran en ello.
La Tabla
Periódica
Historia de la tabla
Periódica:
Los pioneros en crear una tabla periódica fueron
los científicos Dimitri Mendeleiev y Julius
Lothar Meyer, hacia el año 1869. Dimitri
Mendeleiev fue un químico ruso que propuso una
organización de la tabla periódica de los
elementos, en la cual se agrupaban estos en filas y columnas
según sus propiedades químicas; también
Julius Lothar Meyer realizo un ordenamiento, pero
basándose en las propiedades físicas de los
átomos, más precisamente, los volúmenes
atómicos
En 1829 el químico
alemán Döbereiner realizo el primer
intento de establecer una ordenación en los elementos
químicos, haciendo notar en sus trabajos las similitudes
entre los elementos cloro, bromo e iodo por un lado y la
variación regular de sus propiedades por otro.
Una de las propiedades que parecía variar
regularmente entre estos era el peso
atómico.
Desde 1850 hasta 1865 se descubrieron
muchos elementos nuevos y se hicieron notables progresos en la
determinación de las masas atómicas, además,
se conocieron mejor otras propiedades de los mismos.
Fue en 1864 cuando estos intentos
dieron su primer fruto importante,
cuando Newlands estableció la ley de las
octavas. Habiendo ordenado los elementos conocidos por su peso
atómico y después de disponerlos en columnas
verticales de siete elementos cada una, observó que en
muchos casos coincidían en las filas horizontales
elementos con propiedades similares y que presentaban una
variación regular.
Esta ordenación, en columnas de
siete da su nombre a la ley de las octavas,
recordando los periodos musicales. En algunas de las filas
horizontales coincidían los elementos cuyas similitudes ya
había señalado Döbereiner. El fallo principal
que tuvo Newlands fue el considerar que sus columnas verticales
(que serían equivalentes a períodos en la tabla
actual) debían tener siempre la misma longitud. Esto
provocaba la coincidencia en algunas filas horizontales de
elementos totalmente dispares y tuvo como consecuencia el que sus
trabajos fueran desestimados.
En 1869 el químico alemán Julius
Lothar Meyer y el químico ruso Dimitri
Ivanovich Mendelyev propusieron la primera "Ley
Periódica".
Meyer al estudiar los volúmenes
atómicos de los elementos y representarlos frente al peso
atómico observó la aparición en el
gráfico de una serie de ondas. Cada bajada desde un
máximo (que se correspondía con un metal alcalino)
y subido hasta el siguiente, representaba para Meyer un periodo.
En los primeros periodos, se cumplía la ley de las
octavas, pero después se encontraban periodos mucho
más largos.
Utilizando como criterio la valencia de
los distintos elementos, además de su peso
atómico, Mendelyev presentó su
trabajo en forma de tabla en la que los periodos se rellenaban de
acuerdo con las valencias (que aumentaban o disminuían de
forma armónica dentro de los distintos periodos) de los
elementos.
Esta ordenación daba de nuevo lugar a otros
grupos de elementos en los que coincidían elementos de
propiedades químicas similares y con una variación
regular en sus propiedades físicas.
La tabla explicaba las observaciones de Döbereiner,
cumplía la ley de las octavas en sus primeros periodos y
coincidía con lo predicho en el gráfico de Meyer.
Además, observando la existencia de huecos en su tabla,
Mendelyev dedujo que debían existir elementos que
aún no se habían descubierto y además
adelanto las propiedades que debían tener estos elementos
de acuerdo con la posición que debían ocupar en la
tabla.
El descubrimiento de los
elementos:
Hacia el siglo XVII los elementos químicos eran
considerados cuerpos primitivos y simples que no estaban formados
por otros cuerpos, ni unos de otros; y que eran ingredientes que
componían inmediatamente todos los cuerpos
mixtos.
Aunque algunos elementos como
el oro (Au), plata (Ag), cobre (Cu), plomo (Pb)
y el mercurio (Hg) ya eran conocidos desde la
antigüedad, el primer descubrimiento científico de un
elemento ocurrió en el siglo XVII cuando el
alquimista Henning Brand descubrió
el fósforo (P).
En el siglo XVIII se conocieron numerosos nuevos
elementos, los más importantes de los cuales fueron los
gases, con el desarrollo de la química
neumática: oxígeno (O), hidrógeno (H)
y nitrógeno (N). También se
consolidó en esos años la nueva concepción
de elemento, que condujo a Antoine Lavoisier a
escribir su famosa lista de sustancias simples, donde
aparecían 33 elementos. A principios del siglo XIX, la
aplicación de la pila eléctrica al estudio de
fenómenos químicos condujo al descubrimiento de
nuevos elementos, como los metales alcalinos y
alcalino–térreos, sobre todo gracias a los trabajos
de Humphry Davy.
En 1830 ya se conocían 55 elementos.
Posteriormente, a mediados del siglo XIX, con la invención
del espectroscopio, se descubrieron nuevos elementos, muchos
de ellos nombrados por el color de sus líneas espectrales
características: cesio (Cs, del
latín caesius, azul), talio (Tl,
de tallo, por su color verde), rubidio (Rb, rojo),
etc.
Antes de 1800 (34 elementos):
descubrimientos durante y antes del Siglo de las
Luces.1800-1849 (+24 elementos):
Revolución científica y Revolución
industrial.1850-1899 (+26 elementos): el
periodo de las clasificaciones de los elementos
recibió el impulso del análisis de
los espectros: Boisbaudran,
Bunsen, Crookes, Kirchhoff, y otros "cazadores de
trazas en las líneas de emisión de
los espectros".1900-1949 (+13 elementos): impulso
con la antigua teoría cuántica y
la mecánica cuántica.1950-2000 (+17 elementos):
descubrimientos "después de la bomba atómica":
elementos de números atómicos 98 y posteriores
(colisionadores, técnicas de bombardeo).2001-presente (+4 elementos):
descubrimientos muy recientes, que no están
confirmados.
La noción de elemento y las
propiedades periódicas:
Lógicamente, un requisito previo necesario a la
construcción de la tabla periódica era el
descubrimiento de un número suficiente de elementos
individuales, que hiciera posible encontrar alguna pauta en
comportamiento químico y sus propiedades. Durante los
siguientes dos siglos se fue adquiriendo un mayor conocimiento
sobre estas propiedades, así como descubriendo muchos
elementos nuevos.
La palabra "elemento" procede de la ciencia griega, pero
su noción moderna apareció a lo largo del siglo
XVII, aunque no existe un consenso claro respecto al proceso que
condujo a su consolidación y uso generalizado. Algunos
autores citan como precedente la frase de Robert
Boyle en su famosa obra El químico
escéptico, donde denomina elementos "ciertos
cuerpos primitivos y simples que no están formados por
otros cuerpos, ni unos de otros, y que son los ingredientes de
que se componen inmediatamente y en que se resuelven en
último término todos los cuerpos perfectamente
mixtos". En realidad, esa frase aparece en el contexto de la
crítica de Robert Boyle a los cuatro elementos
aristotélicos.
A lo largo del siglo XVIII, las tablas de
afinidad recogieron un nuevo modo de entender la
composición química, que aparece claramente
expuesto por Lavoisier en su obra Tratado
elemental de química. Todo ello condujo a diferenciar
en primer lugar qué sustancias de las conocidas
hasta ese momento eran elementos químicos, cuáles
eran sus propiedades y cómo aislarlas.
El descubrimiento de gran cantidad de elementos nuevos,
así como el estudio de sus propiedades, pusieron de
manifiesto algunas semejanzas entre ellos, lo que aumentó
el interés de los químicos por buscar algún
tipo de clasificación.
Los pesos
atómicos:
El peso atómico (También
llamado Masa Atómica Relativa)
(símbolo: Ar) es una cantidad
física adimensional definida como la suma de la
cantidad de las masas promedio de
los átomos de un elemento (de un
origen dado) expresados en Unidad de masa
atómica o U.M.A. (es decir, a 1/12 de la masa de
un átomo de carbono 12). El concepto
se utiliza generalmente sin mayor calificación para
referirse al peso atómico
estándar.
Los valores de estos pesos atómicos
estándar están reimpresos en una amplia variedad de
libros de texto, catálogos comerciales, póster,
etcétera. Para describir esta cantidad física se
puede usar también la expresión masa
atómica relativa. En consecuencia, desde por lo menos
1860 y hasta el decenio de 1960, el uso continuado
de la locución ha atraído una controversia
considerable.
A diferencia de las masas atómicas (las masas de
los átomos individuales), los pesos atómicos no
son constantes físicas. Varían de
una muestra a otra. Sin embargo, en
muestras normales son suficientemente constantes
para ser de importancia fundamental en química. Se ha
de no confundir al peso atómico con la masa
atómica.
El peso atómico fue desarrollado por
John Dalton en el siglo XIX, su aporte consistió en
la formulación de un atomismo químico que integraba
el elemento y las leyes ponderales. Este científico, tomo
sustancias de su época y supuso como se combinaban los
átomos de estas, tomo como referencia la masa de una
átomo de hidrogeno y a partir de experiencias y
suposiciones construyó la primera tabla de masas
atómicas relativas. Esta tabla se perfecciono con el
congreso de karlsruhe en 1860. Dalton empleó
los conocimientos sobre proporciones en las que reaccionaban las
sustancias de su época y realizó algunas
suposiciones sobre el modo como se combinaban los
átomos de las mismas.
Por ejemplo, en el caso del oxígeno, Dalton
partió de la suposición de que el agua era
un compuesto binario, formado por un átomo de
hidrógeno y otro de oxígeno. No tenía
ningún modo de comprobar este punto, por lo que tuvo que
aceptar esta posibilidad como una hipótesis a
priori.
Dalton sabía que 1 parte de hidrógeno se
combinaba con 7 partes (8 afirmaríamos en la actualidad)
de oxígeno para producir agua. Por lo tanto, si la
combinación se producía átomo a
átomo, es decir, un átomo de hidrógeno se
combinaba con un átomo de oxígeno, la
relación entre las masas de estos átomos
debía ser 1:7 (o 1:8 se calcularía en la
actualidad). El resultado fue la primera tabla de masas
atómicas relativas (o pesos atómicos, como los
llamaba Dalton) que fue posteriormente modificada y desarrollada
en los años posteriores. Las inexactitudes antes
mencionadas dieron lugar a toda una serie de polémicas y
disparidades respecto a las fórmulas y
los pesos atómicos, que solo comenzarían a
superarse, aunque no totalmente, en el congreso de
Karlsruhe en 1860.
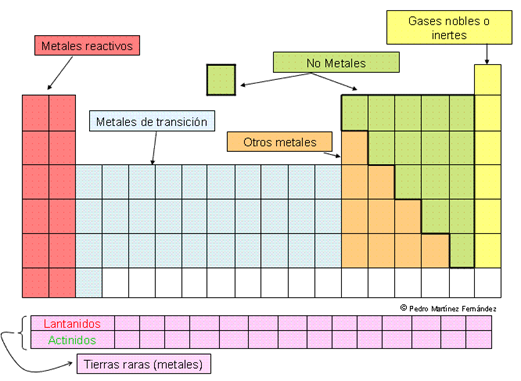
Metales, no metales y metaloides o
metales de transición:
La primera clasificación de elementos conocida,
fue propuesta por Antoine Lavoisier, quien propuso
que los elementos se clasificaran en metales, no
metales y metaloides o metales de
transición. Aunque muy práctico y todavía
funcional en la tabla periódica moderna, fue rechazada
debido a que había muchas diferencias tanto en
las propiedades físicas como en
las químicas.
Antoine-Laurent de Lavoisier
químico, biólogo y economista francés,
considerado el creador de la química moderna, junto a
su esposa, la científica Marie-Anne Pierrette
Paulze, por sus estudios sobre la oxidación de los
cuerpos, el fenómeno de la respiración animal,
el análisis del aire, la ley de
conservación de la masa o ley
Lomonósov-Lavoisier, la teoría
calórica y la combustión.
Se llama metales a
los elementos químicos caracterizados
por ser buenos conductores del calor y la
electricidad. Poseen alta densidad y son sólidos en
temperaturas normales (excepto el mercurio); sus sales
forman iones electropositivos (cationes) en
disolución.

Los metales los solemos clasificar de la siguiente
forma:
Metales reactivos. Se denomina así a los
elementos de las dos primeras columnas (alcalinos y
alcalinotérreos) al ser los metales más
reactivos por regla general.Metales de transición. Son los elementos que
se encuentran entre las columnas largas, tenemos los de
transición interna (grupos cortos) y transición
externa o tierras raras (lantánidos y
actínidos).Otros metales. Son los que se encuentran en el resto
de grupos largos. Algunos de ellos tienen propiedades de no
metal en determinadas circunstancias (semimetales o
metaloides).Propiedades de los metales.
Por regla general los metales tienen las siguientes
propiedades:
Son buenos conductores de la
electricidad.Son buenos conductores del calor.
Son resistentes y duros.
Son brillantes cuando se frotan o al
corte.Son maleables, se convierten con facilidad en
láminas muy finas.Son dúctiles, se transforman con facilidad en
hilos finos.Se producen sonidos característicos (sonido
metálico) cuando son golpeados.Tienen altos puntos de fusión y de
ebullición.Poseen elevadas densidades; es decir, tienen mucha
masa para su tamaño: tienen muchos átomos
juntos en un pequeño volumen.Algunos metales tienen propiedades
magnéticas: son atraídos por los
imanes.Pueden formar aleaciones cuando se mezclan
diferentes metales. Las aleaciones suman las propiedades de
los metales que se combinan. Así, si un metal es
ligero y frágil, mientras que el otro es pesado y
resistente, la combinación de ambos podrías
darnos una aleación ligera y resistente.Tienen tendencia a formar iones
positivos.
Hay algunas excepciones a las propiedades
generales enunciadas anteriormente:
El mercurio es un metal pero es
líquido a temperatura ambiente.El sodio es metal pero es blando (se
raya con facilidad) y flota (baja densidad)Se denomina no metales, a
los elementos químicos opuestos a
los metales pues sus características son
totalmente diferentes. Los no metales, excepto el
hidrógeno, están situados en la tabla
periódica de los elementos en
el bloque p. Los elementos de este bloque
son no-metales, excepto los metaloides (B, Si, Ge,
As, Sb, Te), todos los gases nobles (He, Ne, Ar,
Kr, Xe, Rn), y algunos metales (Al, Ga, In, Tl, Sn,
Pb).
Tienden a formar aniones u oxianiones en solución
acuosa. Su superficie es opaca, y son malos conductores de calor
y electricidad. En comparación con los metales, son de
baja densidad, y se derriten a bajas temperaturas. La forma de
los no metales puede ser alterada fácilmente, ya que
tienden a ser frágiles y quebradizos.

Propiedades de los no metales:
Son malos conductores de la electricidad.
Son malos conductores del calor.
Son poco resistentes y se desgastan con
facilidad.No reflejan la luz como los metales, no tienen el
denominado brillo metálico. Su superficie no es tan
lisa como en los metales.Son frágiles, se rompen con
facilidad.Tienen baja densidad.
No son atraídos por los imanes.
Tienen tendencia a formar iones
negativos.
Hay algunas excepciones a las propiedades generales
enunciadas anteriormente:
El diamante es un no metal pero presenta una gran
dureza.El grafito es un no metal pero conduce la
electricidad.Los elementos de
transición son aquellos elementos
químicos que están situados en la parte
central del sistema periódico, en el bloque
d, cuya principal característica es la
inclusión en su configuración
electrónica del orbital d,
parcialmente lleno de electrones. Esta definición
se puede ampliar considerando como elementos de
transición a aquellos que poseen electrones alojados
en el orbital d, esto incluiría
a zinc, cadmio, y mercurio.
La IUPAC define un metal de transición como
"un elemento cuyo átomo tiene una subcapa d incompleta
o que puede dar lugar a cationes".

Los elementos que no se pueden clasificar como
metales o como no metales; tienen propiedades de los dos
grupos y se les llaman metaloides o semimetales. Estos
son el boro (B) del grupo IIA, silicio (Si) del grupo IVA,
germanio (Ge) del grupo IVA, arsénico (As) del grupo
IVA, antimonio (Sb) del grupo VA y telurio (Te) del grupo
VIA.

Semimetales o metaloides.
Se encuentran entre lo metales y los no metales (B, Si,
Ge, As, Sb, Te, Po). Son sólidos a temperatura ambiente y
forman iones positivos con dificultad. Según las
circunstancias tienen uno u otro comportamiento.
Clasificación
Grupos:
A las columnas verticales de la tabla periódica
se les conoce como grupos. Hay 18 grupos en la tabla
periódica estándar, de los cuales diez son grupos
cortos y los ocho restantes largos, que muchos de estos grupos
correspondan a conocidas familias de elementos
químicos: la tabla periódica se ideó para
ordenar estas familias de una forma coherente y fácil de
ver.
Todos los elementos que pertenecen a un grupo tienen la
misma valencia atómica, entendido como el
número de electrones en la última capa, y por ello,
tienen propiedades similares entre sí.
La explicación moderna del ordenamiento en la
tabla periódica es que los elementos de un grupo
poseen configuraciones electrónicas similares y
la misma valencia atómica, o número de
electrones en la última capa.
Dado que las propiedades
químicas dependen profundamente de las interacciones
de los electrones que están ubicados en los niveles
más externos, los elementos de un mismo grupo tienen
propiedades químicas similares.
Por ejemplo, los elementos en el grupo 1 tienen una
configuración electrónica y una valencia
de 1 (un electrón externo) y todos tienden a perder ese
electrón al enlazarse comoiones positivos de +1. Los
elementos en el último grupo de la derecha son
los gases nobles, los cuales tienen lleno su último
nivel de energía (regla del octeto) y, por ello, son
excepcionalmente no reactivos y son también llamados gases
inertes.
Numerados de izquierda a derecha utilizando
números arábigos, según la última
recomendación de la IUPAC (según la
antigua propuesta de la IUPAC) de 1988 y entre paréntesis
según el sistema estadounidense,9 los grupos de la
tabla periódica son:

Grupo 1 (IA), Metales
Alcalinos:
Los metales alcalinos son aquellos que se encuentran en
el primer grupo dentro de la tabla periódica.
Con excepción del hidrógeno, son todos
blancos, brillantes, muy activos, y se les encuentra combinados
en forma de compuestos. Se les debe guardar en la
atmósfera inerte o bajo aceite.
Los compuestos de los metales alcalinos son isomorfos,
lo mismo que los compuestos salinos del amonio. Este radical
presenta grandes analogías con los metales de este
grupo.
Estos metales, cuyos átomos poseen un solo
electrón en la capa externa, son monovalentes. Dada su
estructura atómica, ceden fácilmente el
electrón de valencia y pasan al estado iónico. Esto
explica el carácter electropositivo que poseen, así
como otras propiedades.
Los de mayor importancia son el sodio y el potasio, sus
sales son empleadas industrialmente en gran escala.
Grupo 2 (IIA), Metales
Alcalinotérreos:
Se conocen con el nombre de metales
alcalinotérreos los seis elementos que forman el grupo IIA
del sistema periódico: berilio, magnesio, calcio,
estroncio, bario y radio. Son bivalentes y se les llama
alcalinotérreos a causa del aspecto térreo de sus
óxidos.
El radio es un elemento radiactivo.
Estos elementos son muy activos aunque no tanto como los
del grupo I. Son buenos conductores del calor y la electricidad,
son blancos y brillantes.
Como el nombre indica, manifiestan propiedades
intermedias entre los metales alcalinos y los térreos; el
magnesio y, sobre todo, el berilio son los que más se
asemejan a estos.
No existen en estado natural, por ser demasiado activos
y, generalmente, se presentan formando silicatos, carbonatos,
cloruros y sulfatos, generalmente insolubles.
Estos metales son difíciles de obtener, por lo
que su empleo es muy restringido.
Grupo 3 (IIIB), familia del
Escandio:
La familia del escandio se
compone de todos los integrantes del Grupo 3 de la tabla
periódica (antiguamente III B):
Escandio (Sc)
Itrio (Y)
Lantano (La)
Actinio (Ac)
Elementos de transición
interna (Actínidos y Lantánidos o Tierras
raras)Tendencia a oxidarse y ser muy reactivos. Propiedades
similares al aluminio. Dan lugar a iones incoloros.
Grupo 4 (IVB), Familia
del Titanio:
La familia del titanio se compone de
todos los integrantes del Grupo 4 de la tabla periódica
(antiguamente IV B):
Titanio (Ti)
Circonio (Zr)
Hafnio (Hf)
Rutherfordio (Rf)
Estos metales son bastante reactivos (sobre todo cuando
están en forma de esponja porosa, de gran superficie
específica, son pirofóricos; esto es, al exponerse
a la acción del aire se vuelven rojos e inflaman
espontáneamente). Al estar compactos son pasivos, casi
inatacables por cualquier agente atmosférico.
Grupo 5 (VB), familia del Vanadio:
La familia del vanadio se compone de
todos los integrantes del Grupo 5 y del 6 pasado por los metales
consistentes de materia gris, estos se caracterizan por poseer
calcio de estudios simontinosis aguda, y son el grupo 5,56 de la
tabla periódica (antiguamente V B):
Vanadio (V)
Niobio (Nb)
Tantalo (Ta)
Dubnio (Db)
Todos los elementos de este grupo tienen comportamientos
representativos del nombre que los representa, en este caso es el
vanadio.
Grupo 6 (VIB), familia del Cromo:
La familia del cromo se compone de
todos los integrantes del Grupo 6 de la tabla periódica
(antiguamente VI B):
Cromo (Cr)
Molibdeno (Mo)
Volframio o Tungsteno (W)
Seaborgio (Sg)
Todos los elementos de este grupo tienen comportamientos
representativos del nombre que los representa. En este caso es el
cromo.
Grupo 7 (VIIB), familia del
Manganeso:
La familia del manganeso se compone de
todos los integrantes del Grupo 7 de la tabla periódica
(antiguamente VII B): además se sitúa en el medio
de los elementos de transición.
Manganeso (Mn)
Tecnecio (Tc)
Renio (Re)
Bohrio (Bh)
Todos los elementos de este grupo tienen comportamientos
representativos del nombre que los representa. En este caso es el
manganeso.
Grupo 8 (VIIIB), familia del
Hierro:
La familia del hierro se compone de
todos los integrantes del Grupo 8 de la tabla periódica
(antiguamente VIII B):
Hierro (Fe)
Rutenio (Ru)
Osmio (Os)
Hassio (Hs)
Todos los elementos de este grupo tienen comportamientos
físico-químicos representativos del nombre que los
representa. En este caso es el hierro.
Grupo 9 (IXB), familia del
Cobalto:
La familia del cobalto se compone de
todos los integrantes del Grupo 9 de la tabla
periódica (antiguamente IX B):
Cobalto (Co)
Rodio (Rh)
Iridio (Ir)
Meitnerio (Mt)
Todos los elementos de este grupo tienen comportamientos
físico-químicos representativos del nombre que los
representa. En este caso es el cobalto.
Grupo 10 (XB), familia del
Níquel:
La familia del níquel se compone
de todos los integrantes del Grupo 10 de la tabla
periódica (antiguamente X B):
Níquel (Ni)
Paladio (Pd)
Platino (Pt)
Darmstadio (Ds) (anteriormente Ununnilio
(Uun))
Todos los elementos de este grupo tienen comportamientos
físico-químicos representativos del nombre que los
representa. En este caso es el níquel.
Grupo 11 (IB), familia del Cobre:
La familia del cobre o vulgarmente
conocidos como metales de acuñación se
componen de todos los integrantes del Grupo 11 de la tabla
periódica(antiguamente I B):
Cobre (Cu)
Plata (Ag)
Oro (Au)
Roentgenio (Rg)
o Unununium (Uuu)
Todos los elementos de este grupo tienen comportamientos
físico-químicos representativos del nombre que los
representa. En este caso es el Cobre.
Grupo 12 (IIB), familia del Cinc:
La familia del Zinc se compone de todos
los integrantes del Grupo 12 de la tabla periódica
(antiguamente II B):
Zinc (Zn)
Cadmio (Cd)
Mercurio (Hg)
Copernicio (Cn) (anteriormente Ununbio
(Uub))
Todos los elementos de este grupo tienen comportamientos
físico-químicos representativos del nombre que los
representa en este caso es el zinc.
Grupo 13 (IIIA), Los
Térreos:
Los elementos que pertenecen al grupo III,
llamados TÉRREOS, son el boro,
aluminio, galio, indio y talio. Tienen 3 electrones en el
último nivel, siendo su configuración
electrónica externa ns2np1. El primero del
grupo, el boro, es un metaloide que no forma compuestos
iónicos binarios ni reacciona con el oxígeno o el
agua.
El siguiente elemento, el aluminio, forma
fácilmente óxidos al exponerse al aire, y la capa
de óxido que se deposita lo hace menos reactivo que el
aluminio elemental. El aluminio también reacciona con el
ácido clorhídrico (HCl) desprendiendo
hidrógeno. Los restantes elementos del grupo tienden a
perder solo los electrones de los orbitales p (1) formando iones
unipositivos.
Estos metales forman también compuestos
moleculares lo que muestra la variación
gradual dentro de la tabla desde el carácter
metálico al no metálico.
Grupo 14 (IVA), Los Carbonoideos:
El grupo IV de la tabla
periódica de los elementos (antiguo grupo IV A),
también conocido como grupo del carbono o
de los carbonoideos, está formado por los
siguientes elementos:
carbono (C), silicio (Si), germanio (Ge), estaño (Sn)
y plomo (Pb).
La mayoría de los elementos de este grupo son muy
conocidos y difundidos, especialmente el carbono, elemento
fundamental de la química orgánica. A su vez,
el silicio es uno de los elementos más abundantes en
la corteza terrestre (28%), y de gran importancia en la
sociedad a partir del siglo XXI, ya que es el elemento
principal de los circuitos integrados.
Al bajar en el grupo, estos elementos van teniendo
características cada vez más metálicas: el
carbono es un no metal, el silicio y el germanio
son semimetales, y el estaño y el plomo son
metales.
Grupo 15 (VA), Los Nitrogenoideos:
El grupo del
nitrógeno está compuesto por los elementos
químicos del grupo 15 de la tabla
periódica: nitrógeno (N), fósforo (P), arsénico (As), antimonio (Sb), bismuto (Bi)
y el elemento sintético ununpentio (Uup), cuyo
descubrimiento aún no ha sido confirmado. Estos elementos
también reciben el nombre
de pnicógenos o nitrogenoideos.
Grupo 16 (VIA), los Calcógenos o
Anfígenos:
Los cinco primeros elementos son no-metálicos, el
último, polonio, es radioactivo. El oxígeno es un
gas incoloro constituyente del aire. El agua y la tierra. El
azufre es un sólido amarillo y sus compuestos por lo
general son tóxicos o corrosivos. La química del
teluro y selenio es compleja.
El grupo de
los anfígenos o calcógenos es
también llamado familia del oxígeno y es
el grupo conocido antiguamente como VIA, y actualmente
grupo 16 (según la IUPAC) en la tabla
periódica de los elementos, formado por los siguientes
elementos: oxígeno (O), azufre (S), selenio (Se),telurio (Te)
y polonio (Po).
Aunque todos ellos tienen seis electrones de
valencia (última capa s2p4), sus propiedades varían
de no metálicas a metálicas en cierto grado,
conforme aumenta su número atómico.
El oxígeno y el azufre se utilizan abiertamente
en la industria y el telurio y el selenio en la
fabricación de semiconductores.
Grupo 17 (VIIA), Halógenos:
El flúor, el cloro, el bromo, el yodo y el
astato, llamados metaloides halógenos, constituyen el
grupo de los no metales monovalentes. Todos ellos son coloreados
en estado gaseoso y, desde el punto de vista químico,
presentan propiedades electronegativas muy acusadas, de donde se
deriva la gran afinidad que tienen con el hidrógeno y los
metales.
Los formadores de sal se encuentran combinados en la
naturaleza por su gran actividad. Las sales de estos elementos
con los de los grupos I y II están en los mares. Las
propiedades de los halógenos son muy semejantes. La
mayoría se sus compuestos derivados son tóxicos,
irritantes, activos y tienen gran aplicación tanto en la
industria como en el laboratorio.
El astatinio o ástato difiere un poco del resto
del grupo.
Grupo 18 (VIIIA), Los Gases
Nobles:
Los gases nobles son un grupo
de elementos químicos con propiedades muy
similares: bajo condiciones normales, son
gases monoatómico sinodoros, incoloros y presentan
una reactividad química muy baja. Se
sitúan en el grupo 18 (8A) de la tabla
periódica (anteriormente llamado grupo 0). Los
seis gases nobles que se encuentran en la naturaleza
son helio (He), neón (Ne), argón (Ar), kriptón (Kr), xenón (Xe)
y el radiactivo radón (Rn).
Las propiedades de los gases nobles pueden ser
explicadas por las teorías modernas de la estructura
atómica: a su capa
electrónica de electrones valentes se la
considera completa, dándoles poca tendencia
a participar en reacciones químicas, por lo que
sólo unos pocos compuestos de gases nobles han
sido preparados hasta 2008.
El neón, argón, kriptón y
xenón se obtienen del aire usando los métodos
de licuefacción y destilación
fraccionada. El helio es típicamente separado del gas
natural y el radón se aísla normalmente a
partir del decaimiento radioactivo de compuestos
disueltos del radio. Los gases nobles tienen muchas
aplicaciones importantes en industrias como iluminación,
soldadura y exploración espacial. La
combinación helio-oxígeno-nitrógeno (trimix)
se emplea para respirar en inmersiones de profundidad para evitar
que los buzos sufran el efecto narcótico del
nitrógeno. Después de verse los riesgos causados
por la inflamabilidad del hidrógeno, éste fue
reemplazado por helio en los dirigibles y globos
aerostáticos.
Periodos
En la tabla periódica los elementos
están ordenados de forma que aquellos con propiedades
químicas semejantes, se encuentren situados cerca uno de
otro.
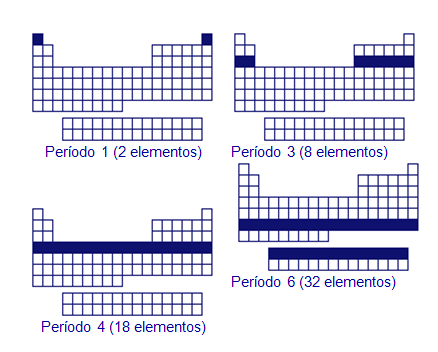
Los elementos se distribuyen en filas horizontales,
llamadas períodos. Pero los periodos no son todos iguales,
sino que el número de elementos que contienen va
cambiando, aumentando al bajar en la tabla
periódica.
El primer periodo tiene sólo dos elementos,
el segundo y tercer periodo tienen ocho elementos, el
cuarto y quinto periodos tienen dieciocho, el sexto periodo tiene
treinta y dos elementos, y el séptimo no tiene
los treinta y dos elementos porque está incompleto.
Estos dos últimos periodos tienen catorce elementos
separados, para no alargar demasiado la tabla y facilitar su
trabajo con ella.
El periodo que ocupa un elemento coincide con su
última capa electrónica. Es decir, un elemento
con cinco capas electrónicas, estará en
el quinto periodo. El hierro, por ejemplo, pertenece al
cuarto periodo, ya que tiene cuatro capas
electrónicas.
Página siguiente  |
