 Página anterior Página anterior |   Voltar ao início do trabalho Voltar ao início do trabalho | Página seguinte  |
A Hepatite viral é uma infecção comum do fígado, e apesar de muitos vírus poderem causar a Hepatite, somente cinco deles são importantes e são descritos como "vírus da Hepatite", já que seu principal sítio de ação é o fígado (LEVINSON; JANETZ, 2005, p. 267).
Os cinco vírus são: o vírus da Hepatite A (HAV), o vírus da Hepatite B (HBV), o vírus da Hepatite C (HCV), o vírus da Hepatite D (HDV ou vírus delta) e o vírus da Hepatite E (HEV). Outros vírus como o vírus de Epstein-Barr (o agente da mononucleose infecciosa), o citomegalovírus e o vírus da febre amarela, causam inflamação do fígado mas também infestam outros sítios do corpo e, dessa forma não são exclusivos de Hepatite (LEVINSON; JANETZ, 2005, p. 267).
Em muitos dos pacientes infectados, as células hepáticas lesadas se regeneram, deixando pouco ou nenhuma lesão permanente, entretanto, alguns fatores como idade avançada e distúrbios subjacentes sérios fazem as complicações mais prováveis. Na Hepatite viral ocorre uma destruição de células hepáticas, morte celular (necrose) e destruição de células (autólise), levando à anorexia, hepatomegalia e icterícia (Springhouse Corporation, 2004, p. 292).
O Vírus da Hepatite A é quase que exclusivamente transmitido via fecal-oral, e os surtos são comuns em áreas de aglomerações humanas e de condições de saneamento precário, os centros de tratamento diário e outros estabelecimentos institucionais são fontes comuns de surtos, além de observado uma incidência crescente entre homossexuais e em pessoas portadoras de HIV (Springhouse Corporation, 2004, p. 293).
O vírus da Hepatite B, também é crescente em portadores de HIV, contribuindo com 5% a 10% dos casos de Hepatites pós-transfusional nos Estados Unidos, sendo a vacinação agora exigida para os trabalhadores da área da saúde e em crianças em idade escolar em diversos estados americanos (Springhouse Corporation, 2004, p. 293).
A maioria dos casos de Hepatite seguidas de transfusões são relacionadas ao vírus da Hepatite C, bem como 20% de todas as Hepatites virais. Já o vírus da Hepatite D, nos Estados Unidos, está restrito a pessoas que freqüentemente estão expostas a produtos sanguíneos, como usuários de drogas e hemofílicos (Springhouse Corporation, 2004, p. 293).
O vírus da Hepatite E anteriormente foi agrupado com o grupo C, sob o nome de Hepatite não-A, não B, nos Estados Unidos este tipo de vírus ocorre principalmente em pessoas que visitaram uma área endêmica como Índia, África, Ásia, ou América central (Springhouse Corporation, 2004, p. 293). Na Tabela 1 encontram-se as principais características das Hepatites virais.
Tabela 1. Principais Características das Hepatites Virais.
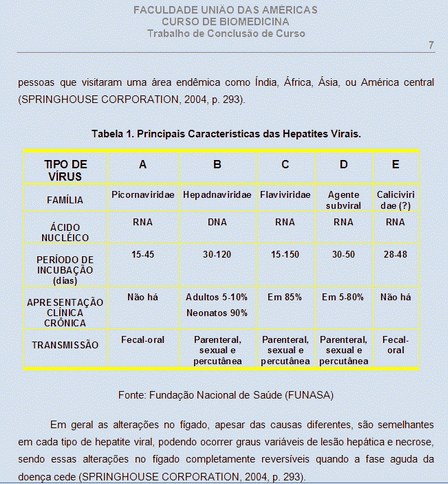
Fonte: Fundação Nacional de Saúde (FUNASA), 2007
Em geral as alterações no fígado, apesar das causas diferentes, são semelhantes em cada tipo de Hepatite viral, podendo ocorrer graus variáveis de lesão hepática e necrose, sendo essas alterações no fígado completamente reversíveis quando a fase aguda da doença cede (Springhouse Corporation, 2004, p. 293).
Uma complicação relativamente comum é a Hepatite persistente crônica, que prolonga a recuperação a até 8 meses. Alguns pacientes também sofrem recidivas. Alguns pacientes podem desenvolver Hepatite ativa crônica, que destrói parte do fígado e provoca cirrose. Em casos raros, insuficiência hepática grave e súbita (fulminante) e morte podem resulta da perda maciça de tecido (Springhouse Corporation, 2004, p. 293).
Na figura1 podemos verificar o número de casos confirmados de Hepatites A, B e C no Brasil entre os anos de 1996 a 2000, e a incidência de acordo com o sexo. Na figura 2 estão dispostos os dados sobre a distribuição em percentual dos casos detectados de Hepatites virais com histórico de transfusão no Brasil, 2001.
Figura 1. Casos Confirmados de Hepatites Virais, Brasil, 1996 a 2000.
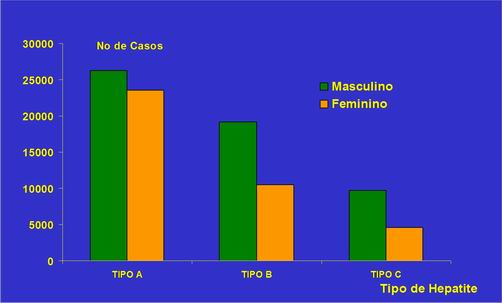
Fonte: Fundação Nacional de Saúde (FUNASA), 2007
Figura 2. Distribuição em percentual dos casos detectados de Hepatites virais com histórico de transfusão no Brasil. 2001
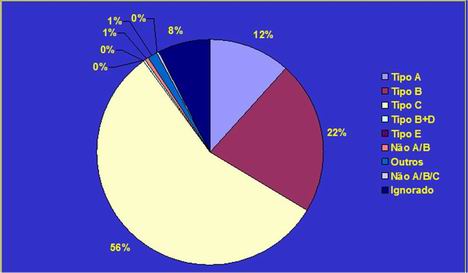
Fonte: Fundação Nacional de Saúde (FUNASA)
Na figura 3 observamos o percentual de casos confirmados de Hepatites virais com etiologia indefinida e municípios silenciosos do estado do Paraná, onde a região oeste do Paraná em quase seu total de municípios tem um percentual de casos menor ou igual a 25%. A tabela 2 apresenta os números de casos e incidência (por 100 mil habitantes) no Paraná segundo o tipo de Hepatite.
Figura 3. Distribuição por município do percentual de casos confirmados de Hepatites virais com etiologia indefinida e municípios silenciosos. Paraná, 2004.
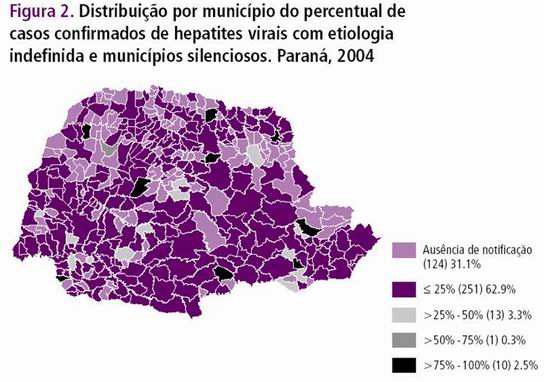
Fonte: SISTEMA DE VIGILÂNCIA EM SAÚDE, 2006.
Tabela 2. Número de casos confirmados e incidência* segundo tipo de Hepatite. Paraná, Região Sul, Brasil, 2004.
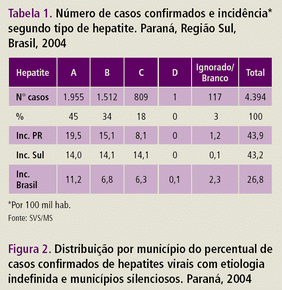
Fonte: SISTEMA DE VIGILÂNCIA EM SAÚDE, 2006
Em 1965, Blumberg e seus colaboradores descobriram que em algum pacientes hemofílicos, politransfundidos, possuíam anticorpos que reagiam com partículas antigênicas de seu painel sorológico, essas partículas eram provenientes de um aborígine australiano. Posteriormente, fora identificado o mesmo antígeno em pacientes com Hepatite, que haviam recebido transfusão sanguínea, surgindo assim uma correlação etiológica. Por esse motivo, o antígeno de superfície da Hepatite B (HBsAg), estrutura que constitui o envoltório desse vírus era chamado de "Antígeno Austrália" (Mendes; PiTtella, 1994, p. 36).
No ano de 1970 Dane juntamente com a ajuda de seus colaboradores identificaram o vírus completo da Hepatite B, a partir da análise do sangue de indivíduos infectados, e logo em 1973 Kaplan detectou um DNA endógeno dependente de um DNA polimerase encontrado no interior das partículas, confirmando assim a sua natureza viral, a partir desses dados Robinson pode caracterizar o genoma do vírus da Hepatite B em 1974 (Mendes; PiTtella, 1994, p. 36).
Hoje se sabe que o vírus da Hepatite B, também conhecido como HBV, pertence ao gênero Orthohepadnavirus, e é membro da família Hepadnaviridae (hepadnavírus), sendo uma partícula que mede aproximadamente 42 nm representado por um nucleocapsídeo icosaédrico, que contem um genoma de DNA circular de fita dupla, e um envelope composto pela proteína chamada de antígeno de superfície (HBsAg) como já mencionado (LEVINSON; JANETZ, 2005, p. 268).
A microscopia eletrônica possibilitou a identificação de três estruturas diferenciadas, poucos virions,que são partículas mais complexas com 42 nm de diâmetro, e que representa o vírion completo da Hepatite B ("partícula de Dane"), e são infectantes, muitas partículas esféricas de diâmetros 20 nm de diâmetro, não infectantes, e filamentos de 20 nm de largura que são compostos pelo antígeno de superfície também não são infectantes.O HBsAg com mais alguns lipídeos derivado do hospedeiro, ou seja a pessoa infectada, incluem quase que exclusivamente essas partículas esféricas e os filamentos. O ácido nucléico viral encontra-se no interior da partícula de HBV, na região conhecida como core ou cerne, e sua estrutura possui 27 nm de diâmetro, além do ácido nucléico nessa estrutura também se encontra uma DNA polimerase e outra partícula antigênica "E" (HBeAg). Essas estruturas são importantes marcadores para saber se há replicação viral na pesquisas clínicas (Mendes; PiTtella, 1994, p. 36). A figura 4 ilustra um modelo esquemático do vírus da Hepatite B e seus antígenos.
Figura 4. Vírus da Hepatite B e seus Antígenos
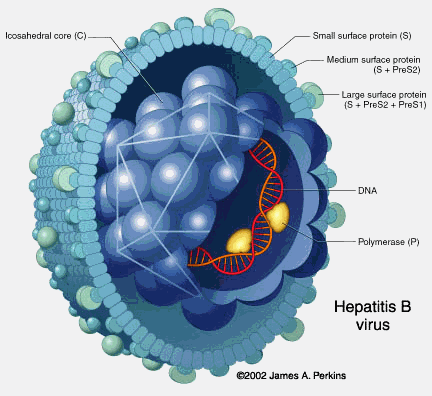
Fonte: http://www.rit.edu/~japfaa/infectious.html
Através de modernas técnicas de recombinação genética que permitiram a clonagem de suas estruturas, foram codificados quatro polipepitideos maiores que são o gene S, codificando para o polipepitideos HBcAg, o gene C, codificando para o polipepitideo HBcAg, o gene "p", supostamente codificando para o DNA polimerase, e o gene x que codifica para uma proteína de 154 aminoácios, sendo este último por sua vez antigênica no homem, que poderá agir na ativação de genes celulares incluindo as proteínas do complexo de histocompatibilidade de classe 1, em outras palavras uma importante proteína que está ligada a resposta imunológica do hospedeiros contra células hepáticas infectadas (Mendes; PiTtella, 1994, p. 37).
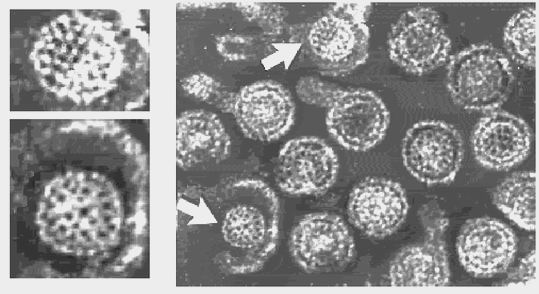
As figuras 5 e 6 mostram a representação esquemática das partículas virais do HBV no soro de pessoas infectadas.
Figura 5. Representação Esquemática das Partículas Virais do HBV Encontrada no Soro de Pessoas Infectadas
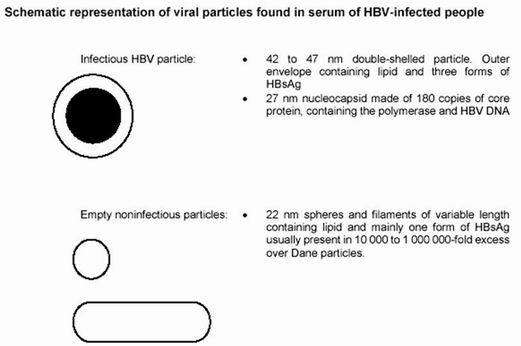
Fonte: http://www.who.int/emc
Figura 6. Representação esquemática do HBV
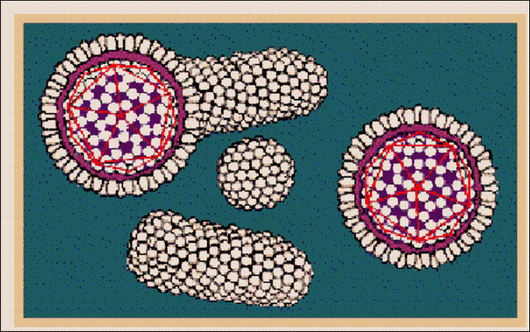
Fonte: http://www.who.int/emc
As figuras 7 e 8 são imagens de microscopia eletrônica das partículas virais do HBV, as setas apontam para a região expostas de dois cerne.
Figura 7. Microscopia Eletrônica do HBV
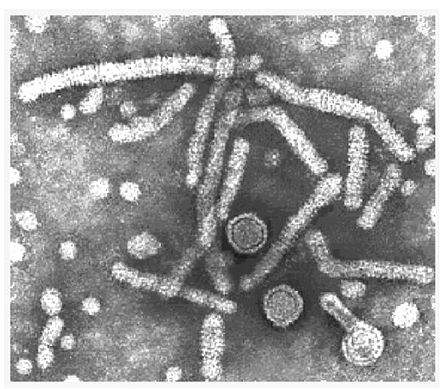
Fonte: http://www.who.int/emc
Figura 8. Microscopia Eletrônica do HBV
Fonte: http://www.who.int/emc
1.1.2 Ciclo Replicativo do HBV
O HBV, de acordo com Levinson e Janetz (2005, p. 268) possui especificidade pelas células hepáticas que podem ser baseada em duas propriedades: os receptores vírus-específicos presentes na membrana das células hepáticas, que facilitam assim a invasão, e fatores de transcrição encontrados somente no hepatócito, o que reforça a síntese do mRNA viral logo após a entrada.
Levinson e Janetz (2005, p. 268) acrescentam ainda que "HBV é o único vírus que produz esfera e filamentos em grande número no sangue do paciente".
Podemos dividir a replição do genoma do HBV em quatro etapas: na primeira etapa ocorre a formação de um DNA circular fechado covalentemente (DNA cfc); na segunda etapa acontece à transcrição do DNA cfc em RNA molde por uma RNA polimerase da célula hospedeira, na terceira ocorre à síntese da "fita" pela trasncriptase reversa do RNA progenômico; e na quarta e última etapa acontece à síntese da "fita +" utilizando a "fita –" como molde, lembrando que o genoma do HBV é composto de DNA parcialmente de fita dupla, sendo uma fita incompleta que não tem um pequeno nick (fita +) e a outra completa (fita –) (MOTA; SILVA, 2003, p. 346). A figura 9 demonstra as etapas de replicação do HBV.
Segundo Levinson e Janetz (2005, p. 269) os hepadnavírus são os únicos vírus que produzem genoma DNA por transcrição reversa com o mRNA como molde, já que uma parte do DNA da progênie integra-se no genoma da célula hospedeira. As novas partículas que são geradas no interior da célula infectada já contêm o envelope de HBsAg e são liberadas por brotamento pela membrana celular.
Figura 9. Ciclo de Vida do HBV
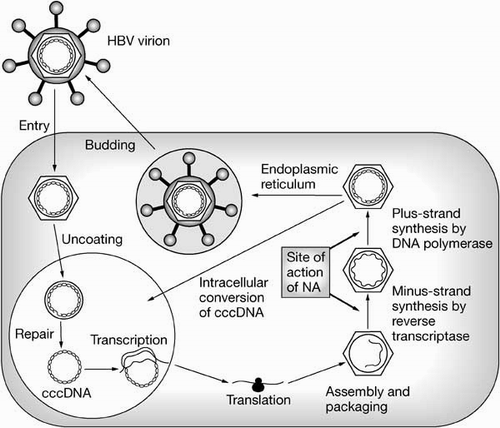
Fonte: http://www.nature.com/ncpgasthep/journal/v1/n2/fig_tab/ncpgasthep0056_F1.html
O HBV não causa diretamente a patologia celular, essa lesão hepatocelular ocorre nesta forma de Hepatite sob a ação do próprio sistema imune do hospedeiro contra os hepatócitos infectados, ou seja, o vírus faz com que as células de defesa ataquem as células do fígado, sendo esse fato essencial para a resolução da doença hepática (MENDES; PITTELLA, 1994, p. 37).
Na infecção aguda dependendo da estimulação dos linfócitos CD4+, pode se desenvolver uma vigorosa resposta imune, que são dirigidas a vários epítopos, que são porções do antígeno que reúnem aspectos físicos e químicos no qual favorecem o reconhecimento a regiões específicas dos anticorpos, e neste caso são expressos nos antígenos AgHBc, AgHBe e AgHBs, a qual não parecem citopáticos para os hepatócitos (MOTA; SILVA, 2003, p. 347).
Após a infecção aguda do hepatócito, fragmentos de moléculas de AgHBc podem expressar-se na superfície dessas células em conjunção com moléculas de produtos de classe I do HLA que são glicoproteínas de superfície celular expressas pelas células nucleadas e envolvidas na regulação de respostas imune, esse complexo seria reconhecido pelos linfócitos TCD8+, que através de sua ação citotóxica promovem a necrose. Aproximadamente 90% das infecções por HBV são assintomáticas, e nos casos em que os portadores são sintomáticos, as manifestações clínicas aparecem cerca de 2 a 6 meses, após o "período de incubação". Essas manifestações surgem após o desaparecimento do quadro prodrômico e raramente duram mais que 4 semanas (MOTA; SILVA, 2003, p. 347).
Segundo Springhouse Corporation (2004, p. 294):
No estágio prodrômico, os seguintes sinais e sintomas podem ser causados por complexos imunológicos circulantes: fadiga, anorexia, leve perda de peso, mal-estar generalizado, depressão, cefaléia, fraqueza, dor articular (artralgia), dor muscular (mialgia), intolerância a luz (fotofobia), náusea e vômitos, alterações nos sentidos de paladar e olfato, febre de 38,7ºC a 38,9ºC, sensibilidade no quadrante superior direito e urina escura e fezes cor de barro (1 a 5 dias antes do início do estágio de icterícia clinica). Durante essa fase, a infecção é muito transmissível.
Já o estágio clínico, também denominado ictérico, começa com 1 a 2 semanas após o estágio prodrômico, sendo a fase da doença verdadeira. O paciente progredindo para este estágio, poderá apresentar sinais e sintomas como: prurido, dor ou sensibilidade abdominal, indigestão, perda de apetite (no inicio do estágio clínico) e icterícia (que pode durar de 1 a 2 semanas, indicando que o fígado lesado não consegue remover bilirrubina do sangue). No entanto a icterícia não indica um agravamento da doença, pois ocasionalmente ocorre Hepatite sem icterícia (Springhouse Corporation, 2004, p. 295).
De acordo com Levson e Janetz (2005, p. 270) os complexos antígeno-anticorpo causam alguns sintomas iniciais como dores nas articulações (artralgias), urticárias e algumas das complicações da Hepatite crônica como por exemplo, glomerulonefrite e vasculite, podendo até preceder a fase aguda.
Estima-se que dos pacientes infectados com HBV, 5% acaba evoluindo para um quadro crônico, costuma-se a considerar um paciente crônico aquele que tenha HBsAg em seu sangue por pelo menos seis meses. Nesse estado a infecção persiste em seus hepatócitos resultando na presença prolongada do HBV e HBsAg no sangue. A adequação do vírus da respostas por células T citotóxicas é uma das principais causas que torna a o paciente portador crônico, isso porque o DNA de HBV existe primeiramente como epissoma no citoplasma das células permanentemente infectadas, ou seja, se mantém no núcleo sem interagir no DNA cromossômico, além de que um pequeno número de cópias de HBV podem estar integrado no DNA celular (LEVINSON; JANETZ, 2005, p. 270).
A Hepatite crônica é mais comum em pacientes que não desenvolveram, ou desenvolveram um mínimo de sintomas na fase aguda, e é mais provável este tipo de infecção em recém-nascidos que em adultos, já que o sistema imune de um adulto é mais competente do que de um bebê. De acordo com o CDC (2007) a cada dez nascimentos de crianças cujas mães estavam contaminadas com HBV, nove crianças se tornavam portadoras crônicas.
Com a lesão dos hepatócitos constantes, há um alto risco de cirrose e carcinoma hepatocelular em portadores crônicos, já que há uma regeneração constante dos tecidos atingidos, e o genoma do HBV poderia se integrar ao DNA do hepatócito ativando oncogenes celulares, levando uma perda do controle do crescimento (LEVINSON; JANETZ, 2005, p. 270).
Pacientes que apresentam severa icterícia na fase aguda da doença, tendem a evoluir para cura, a imunidade duradoura é medida por anticorpos humorais contra HbsAg, tais anticorpos se ligam a superfície antigênica viral neutralizando, ou dificultando a interação com a célula hepática, mas esses anticorpos não são protetores, já que ele apenas impede o contato do vírus com o hepatócito, mas o antícorpo não pode interagir com o "core" que está dentro do vírion (MOTA; SILVA, 2003, p. 347).
A literatura diz que na maioria dos casos, a infecção por HBV é assintomática, e geralmente sendo só detectada pela presença dos anticorpos HBsAg, para Stites et al (1997, p. 414), há poucos achados físicos na infecção aguda pelo HBV, podendo haver manifestações clínicas como icterícia, o fígado pode se encontrar aumentado ou hipersensível, e algumas vezes pode ocorrer esplenomegalia. Na infecção crônica pode ser comum não haver nenhuma anormalidade física até ocorrer lesão hepática crônica, quando surgem outros achados comuns a outras hepatopatias crônicas. Os níveis de aminotransferases podem estar altamente variáveis, podem estar elevados, bem como normais, se houver lesão hepática pode ocorrer diminuição da produção de albumina e aumento do tempo de protrombina.
Levinson e Janetz (2005, p. 269) citam que existem três maneiras de transmissão do vírus da Hepatite B, e as vias seriam por sangue contaminado, relações sexuais e de forma perinatal da mãe para o recém nascido, e faz uma observação em relação à contaminação por perfurocortantes como agulhas de seringas contaminadas que transmitem o vírus indicando que uma quantidade muito pequena de sangue são suficientes para a transmissão.
Já Mota e Silva (2003, p. 347), detalham ainda mais, citando que o vírus está presente em todos os líquidos corporais fisiológicos e patológicos, com exceção das fezes, mas podendo também, propagar-se por contato com secreções corporais, como o sêmen, saliva, suor, lágrimas, leite materno e efusões patológicas. Diálise, acidentes por picada de agulha entre os profissionais da saúde, abuso de drogas intravenosas, atividade homossexual, além é claro de transfusões de hemoderivados constituem as principais categorias de risco.
O modo de transmissão do HBV ainda causa muita controvérsia entre os pesquisadores, existem alguns estudos como o publicado no British Journal of Sports Medicine, citado por Carlos Varaldo do Grupo Otimismo (2007), no qual a Dra. Selda Bereket-Yücel, da Universidade de Izmar na Turquia realizou uma pesquisa sobre o risco de infecção da Hepatite B nos jogos olímpicos, avaliando o sangue e o suor de noventa lutadores de box, no qual nove exames foram positivados. Destes, foram encontrado o vírus no suor de oito. O teste realizado para a detecção do vírus foi o de DNA/HBV, nenhum dos lutadores apresentou anticorpos, configurando uma infecção oculta, conclui a pesquisadora que fez uma alerta sobre uma possível infecção através do suor.
Carlos Varaldo cita no site do Grupo Otimismo (2007) que por não haver existir nenhum caso de contaminação do HBV pelo suor na literatura, pesquisadores consideram as conclusões da pesquisa apressadas, já que ainda existem alguns fatores que podem contradizer tais resultados como baixa imunidade por excesso de exercícios físicos e o uso de anabolizantes. Considerando assim um alerta desproporcional da pesquisadora, já que por não se ter ainda um fundamento cientifico comprovado, aumenta ainda mais o estigma da sociedade em relação à doença, lembrando que toda e qualquer doença como por exemplo uma gripe viral, pode ser encontrada no suor, o que não significa que o mesmo seja uma forma de transmissão .
O CDC, (Centers for Disease Control and Prevention) (2007), afirma que a concentração de HBV em fluídos corporais são consideradas de alto risco no sangue, soro, e exsudatos de ferimentos.
Os considerados de risco moderados são sêmen, fluído vaginal e saliva, e por fim, os de baixo risco são: urina, fezes, lágrimas, suor e leite materno (CDC, 2007).
No site sobre Hepatites, da empresa ROCHE Brasil (2007), admite-se que o HBV pode ser transmitido aos membros de uma mesma família pelo uso comum de escova de dentes, além de barbeadores, lâminas e utensílios de manicura contaminados, alertando também sobre riscos de infecções nos procedimentos de tatuagem e piercings feitos com agulhas contaminadas.
De acordo com Robbins et al (2006, p. 771) "em um terço dos pacientes, a fonte de infecção é desconhecida".
Segundo Ribeiro (1997, p. 23) o primeiro surto de Hepatite B que se tem registro ocorreu em 1883, em trabalhadores que foram vacinados contra varíola com linfa humana, verificando-se em seguida, uma incidência aumentada nos doentes que freqüentavam clinicas que administravam injeções que eram contaminadas com o sangue do portador e não eram adequadamente esterilizadas, por exemplo: clinicas de doenças sexualmente transmissíveis, clinicas de diabetes entre outros. Por um motivo semelhante, militares norte-americanos foram vitimas do maior surto de Hepatite B em 1942, quando receberam uma vacina contra febre amarela que continha soro humano, registrando assim 28.585 casos.
A Organização Mundial da Saúde (OMS) estipula que aproximadamente 30% da população mundial, cerca de dois bilhões de pessoas, já foram infectadas pelo HBV, sendo que 350 milhões destas são portadoras crônicas. A infecção por HBV é responsável por 470.000 mortes por ano.
Na figura 10 podemos observar as áreas de infecção por HBV que vão de alto a moderado, e na figura 11 podemos ver a distribuição da prevalência do antígeno de superfície do HBV.
Figura 10. Distribuição do HBV no Mundo, 2004.
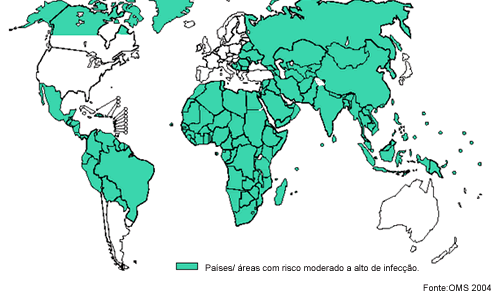
Fonte: OMS (Organização Mundial da Saúde)
Figura 11. Distribuição Geográfica da Prevalência do Antígeno de Superfície da Hepatite B, 2005
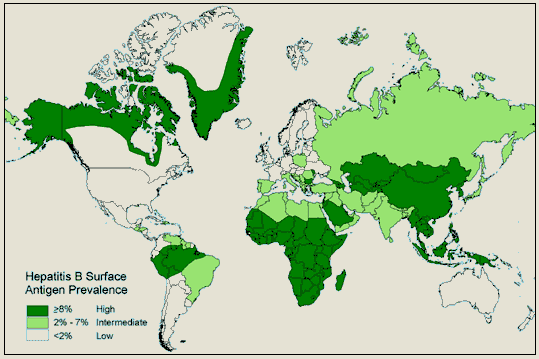
Fonte: <http://www.medic8.com/travel/viral-Hepatitis-b.htm>
De acordo com Ferreira e Silveira (2004, p. 364):
O Ministério da Saúde estima que, no Brasil, pelo menos 15% da população já esteve em contato com o vírus da Hepatite B e que 1% da população apresenta doença crônica relacionada a este vírus. Os estudos epidemiológicos sobre Hepatite B no Brasil são escassos e, em geral, ocuparam-se de grupos populacionais específicos. A análise de base populacional feita no município de São Paulo detectou portadores crônicos em 1,02% (AgHBs +). Há áreas consideradas de alto risco, como no oeste do Paraná e em certas regiões da Amazônia.
Publicações até o inicio da década de 90 classificaram como alta endemicidade, com prevalência superior a 7% a região Amazônica, sul do Espírito Santo e oeste dos estados do Paraná e Santa Catarina. Com endemicidade intermediária, tendo prevalência entre 2 a 7% as regiões nordeste, centro – oeste e sudeste, e por fim a região de baixa endemicidade, abaixo de 2%, a região sul (Ministério da Saúde, 2006).
Uma pesquisa realizada por Manoel C. P. Soares et al (1994, p. 124), constatou um elevado aumento de casos de Hepatites virais, principalmente Hepatite por HBV, em tribos indígenas da Amazônia, onde os primeiros contatos com a sociedade brasileira em 1970 e 1980, somado aos costumes e estilo de vida como, uso comum de objetos em rituais, entre outros fatores, podem ter contribuído para essa alta incidência de infecção, bem como também relata o Ministério da Saúde, sobre essa alta incidência nas regiões amazônicas. Por isso, foi iniciada uma campanha de vacinação em menores de 1 ano, e em 1991 em menores de 15 anos, que diminuíram significativamente os casos de portadores, de 19,3% em 1988 para 3,7% em 1998, além de uma queda significativa na mortalidade.
De 6.019 bolsas testadas no período entre janeiro e dezembro de 2005, do Hospital Universitário de Santa Maria-RS, 3,09% ou 186 bolsas, foram reagentes para anti-HBc, sendo a primeira maior causa de descarte de bolsas de sangue, além de que, 0,17% dessas bolsas foram positivas para o antígeno HBsAg (MACHADO; ZURAVSKI, 2007, p. 108).
Um trabalho realizado por Andrade (2007, p. 674) verificou a prevalência de Hepatites B e C em doadores do Banco de Sangue do Rio de janeiro entre os anos de 1997 e 2005, num estudo de 128.497 casos de amostras coletadas, ressaltando que nesse período 45% eram doadores de repetição, verificando um declínio da prevalência de HBsAg e anti-HBc, e não havendo uma mudança significativa na prevalência de anti-HCV. O total de prevalência de HBsAg nesse período representou um total de 0.27%, um baixo índice em comparação com outras cidades brasileiras como Lábrea no estado da Amazônia (3.3% em 200) e ao estado de Santa Catarina (0.7% em 1994-1995 e em 1999-2001 0.98, 0.84, e 0.64% respectivamente).
Entretanto se os mesmos valores forem comparados à países desenvolvidos como Alemanha (0.16% entre 1997 e 2002), Canadá (0.012% em 2002), Estados Unidos (0.07% em 2002), e Itália (0.003% entre 1997 e 2002), mostram que a prevalência de HBsAg encontra-se elevada (ANDRADE et al, 2007, p. 674).
O antígeno anti-core (HBc) teve uma prevalência total de 3.68% no mesmo período, foram baixos se comparados a outros estados como por exemplo Santa Catarina (8.83%, 7.09% e 5.35% em 1999, 2000 e 2001 respectivamente) e podendo considerar, então, a infecção por HBV, de baixa endemia. A prevalência de anti-HBc no Rio de Janeiro em certos períodos (6.12% em1998) foram similares a alguns países como Colômbia (6.8%) e Panamá (6.7%), e em outros (1997) foram mais altos que alguns países da América Latina, como o Chile (1.15%), Costa Rica (3.8%), Paraguai (5.6%), e Uruguai (4.1%) (ANDRADE et al, 2007, p. 674).
Os estudos de Toledo et al (2005, p. 375), sobre a soroprevalência de HBsAg nas diversas regiões brasileiras, demonstraram que as maiores prevalências se encontram nas regiões Nordeste e Sul, e com os estados em estados mais críticos sendo Amazônia, Espírito Santo, Santa Catarina e Paraná. A figura 12 ilustra os casos confirmados de Hepatite B por Unidade Federativa.
Na figura 13 verifica-se a soroprevalência de HBsAg nas regiões brasileira entre os anos de 1996 e 2000.
Figura 12. Casos Confirmados de Hepatite B por Unidade Federada, Brasil, 1996 a 2000.
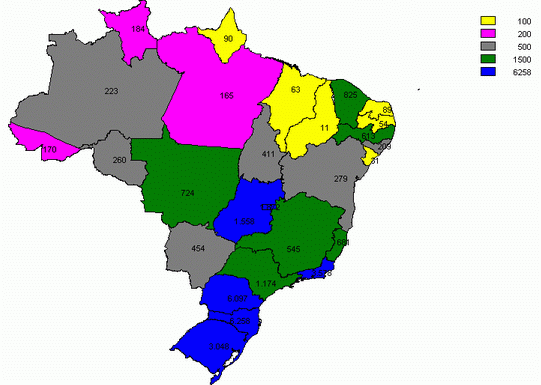
Fonte: SINAN, 2007.
Fig. 13 – Soroprevalência de HBsAg nas regiões brasileiras no ano de 2002
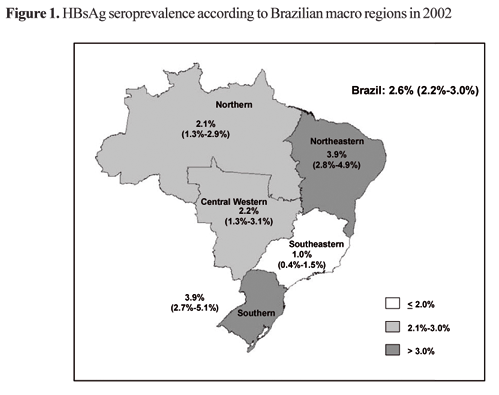
Fonte: TOLEDO JR., Antonio C., GRECO, Dirceu B., FELGA, Marcelo et al. Disponivel em: <http://www.scielo.br/scielo.php?script=sci_arttext&pid=S1413-86702005000500004&lng=en&nrm=iso>.
A figura 14 aponta o número de casos de Hepatite B nos seus respectivos anos no período de 1980 à 2005.
Figura 14 Gráfico da evolução de Hepatite B no Brasil, de 1980 a 2005.
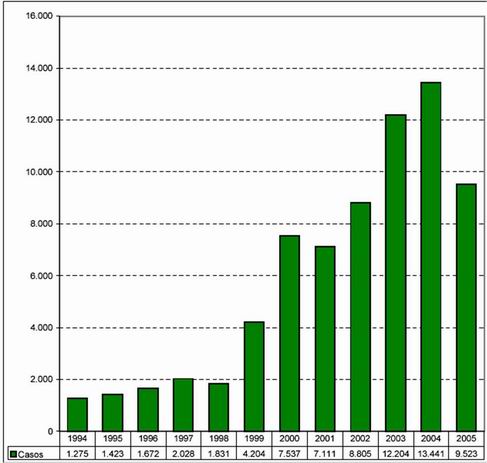
Fonte: Ministério da Saúde
A Secretaria de Saúde do Paraná divulgou que são detectados anualmente pelos Bancos de Sangue de 20.000 a 30.000 novos doadores infectados pelo HBV, dentre os quais 2.000 são portadores. Além disso, o oeste e sudoeste do Paraná eram considerados nessa época, uma das maiores concentrações dos casos de infecção no estado, incluindo cidades como Francisco Beltrão, Pato Branco, Toledo, Cascavel e Foz do Iguaçu. De acordo com as pesquisas de Bertolini et al (2006, p. 1084), há uma prevalência moderada a elevada na região sudoeste do Paraná, em seus estudos com 3188 mulheres grávidas, verificou uma prevalência intermediária para HBV positivo nas cidades de Foz do Iguaçu, Cascavel e Francisco Beltrão, enquanto para as cidades de Curitiba, Londrina, Maringá e Paranaguá essa prevalência apresentou-se baixa. A tabela 3 apresenta a taxa de mortalidade por HBV na região Sul, no Paraná e no Brasil. Na figura 15 verifica-se os casos confirmados por HBV no Paraná.
Segundo o Grupo Otimismo de Apoio ao Portador de Hepatite (2006):
Dados epidemiológicos mostram que do total de doadores do município de Quedas do Iguaçu, aproximadamente 40% são portadores da Hepatite B, sendo inaptos para doação. Devido este grande percentual de portadores da Hepatite B, a Secretaria de Saúde e o Hemocentro de Cascavel, estabeleceram uma parceria para execução do projeto que consiste em realizar a pré triagem sorológica para Hepatite B em candidatos à doação de sangue. Só será realizado exame para aqueles candidatos que realmente desejam tornar-se doadores efetivos.
Figura 15. Casos confirmados de Hepatite por HBV. Paraná 2000-2004.
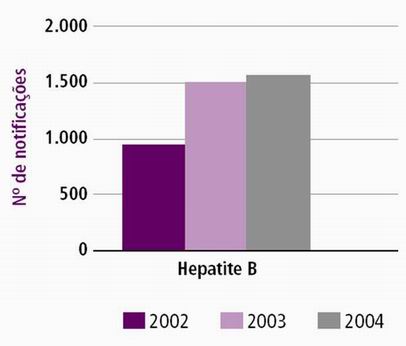
Fonte: SISTEMA DE VIGILÂNCIA EM SAÚDE, 2006.
Tabela 3. Taxa de mortalidade* por HBV. Paraná, Região Sul e Brasil, 2004
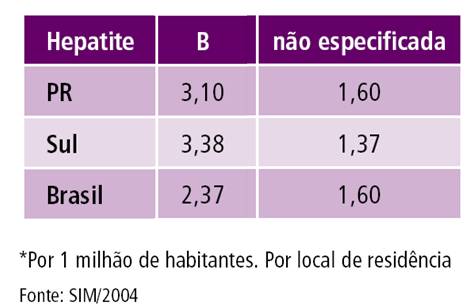
Fonte: SISTEMA DE VIGILÂNCIA EM SAÚDE, 2006.
Conforme os dados da Divisão Epidemiológica de Foz do Iguaçu, que são extraídos do Sistema de Informação de Agravos de Notificações – SINAN, no qual é feito a partir de um levantamento do número de pessoas que são encaminhadas ao ambulatório de Hepatite, através dos Centros de Testagem e Aconselhamento Sorológico – COAS, Hemonúcleo, Postos de Saúde, Redes Particulares, e Laboratórios, e foram confirmadas com Hepatite, no período de Janeiro de 2001 a agosto de 2007, sendo notificados 1.385 casos de Hepatites, aos quais são atribuídos 711 casos à Hepatite B. A figura 16 mostra os casos notificados de Hepatites B, e o número de notificações geral residentes na cidade de Foz do Iguaçu, no qual podemos observar que no ano de 2005 houve o maior número de notificações (274), incluindo a maior incidência de Hepatite pelo vírus B (147).
Figura 16. Número de Notificações de Hepatites e Número de Notificações para Hepatite B Residentes na Cidade de Foz do Iguaçu, 2001-2007*
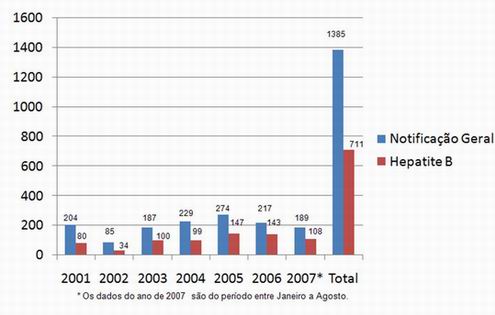
Fonte: Divisão de Vigilância Epidemiológica de Foz do Iguaçu
1.1.6 Diagnóstico Laboratorial e Profilaxia Pós-exposição do HBV
Segundo Ferreira e Ávila (2001, p. 78) "Os marcadores imunológicos da infecção por HBV mais utilizados são o antígeno de superfície (AgHBs) e anticorpos específicos contra o mesmo (anti-HBs), anticorpos específicos contra o antígeno do core (anti-HBc), que podem ser da subclasse IgM ou IgG, e o antígeno "e" (AgHbe) e seus anticorpos específicos anti-HBe)."
Existem também outros marcadores sorológicos como, AgPré-S1/anti-Pré-S1; AgPré-S2/anti-Pré-S2; AgHBx/anti-HBx, e esses por sua vez, são pouco utilizados na rotina, ficando restrito a estudos e investigações (FERREIA; ÁVILA, 2001, p. 79).
O primeiro marcador a ser detectado no sangue ainda na fase prodrômica, ou de janela imunológica, é o AgHBs, que por sua vez, encontram-se muito elevados na fase aguda, o segundo marcador a ser detectado após o AgHBs, é o AgHBe, que indica alto grau de replicação viral, em casos em que ocorrem evolução normal, o AgHBe em poucas semanas é soroconvertido em anti-HBe,quando há uma evolução para as formas crônicas, com a persistência de AgHBe por mais de seis meses, juntamente com a presença de AgHBe geralmente corresponde a um prognóstico de maior gravidade, podendo significar alta replicação viral com dano hepático (FERREIA; ÁVILA, 2001, p. 79).
O terceiro marcador sorológico a ser encontrado é o anti-HBc, ainda na fase aguda, em seguida há o aparecimento gradativo do anti-HBc IgG, ao mesmo tempo que ocorre um desaparecimento do anti-HBc IgM (FERREIRA; ÁVILA, 2001, p. 79).
O anti-HBc do tipo IgG está presente no sangue, após um período de 4 a 6 semanas, e geralmente persiste durante a vida toda (FERREIRA; ÁVILA, 2001, p. 79). A Tabela 4 demonstra os principais perfis de indivíduos infectados por HBV.
Tabela 4 – Principais perfis sorológicos observados em indivíduos infectados.
|
Perfil |
AgHBs |
Anti-HBc IgM |
Anti-HBc IgG |
Anti-HBs |
|
1 |
+ |
- |
- |
- |
|
2 |
+ |
+ |
- |
- |
|
3 |
+ |
+ |
+ |
- |
|
4 |
+ |
- |
+ |
- |
|
5 |
- |
- |
+ |
- |
|
6 |
+ |
- |
+ |
+ |
|
7 |
- |
- |
+ |
+ |
|
8 |
- |
- |
- |
+ |
Fonte: FERREIA, ÁVILA, 2001, p. 79.
O perfil 1, corresponde ao um achado de fase prodrômica, onde o único marcador presente é o AgHBs, sendo este perfil muito pouco freqüente, e devendo sempre ser confirmado para poder descartar um resultado falso positivo. Os perfis 2 e 3 equivale a uma fase aguda, onde o AgHBe geralmente é positivo, sem presença do anti-HBe, mas podendo ocorrer a soroconversão, onde o AgHBe é negativo, podendo haver ou não a presença do anti-HBe. O perfil 4 pode ser comparado a um estágio seguinte a fase aguda, tendendo a recuperação ou estado de portador crônico, o AgHbe positivo, indica maior infectividade e replicação viral, correlacionando também com o comprometimento hepático (FERREIRA; ÁVILA, 2001, p. 79).
O perfil 5 pode ter vários significados como, janela imunológica,conseqüência da transferência passiva por transmissão vertical ou por transfusão sanguínea, quando não há detecção o AgHBs, podendo detectar o DNA do vírus nesses casos, e por fim, um resultado falso-positivo, devido a doenças auto-imunes, mononucleose, entre outros. Perfil 6 corresponde a fase de recuperação. O perfil 7 pode ser uma infecção anterior por HBV que evoluiu para cura e indica imunidade. O perfil 8 é característicos de pessoas que foram vacinadas contra o vírus da Hepatite B (FERREIRA; ÁVILA, 2001, p. 79).
A tabela 5 resume as fases da infecção pelo HBV e os achados sorológicos.
Tabela 5. Fases da Infecção pelo HBV e os Achados Sorológicos
|
Fases da infecção pelo HBV |
|
|
Infecção Aguda |
HBsAg e anti HBc IgM positivos |
|
Cura |
Presença do Anti HBc total e Anti HBs |
|
Infecção Crônica |
HBsAg e Anti HBc total positivos* |
*Dependendo da fase evolutiva, positividade ou não do HBeAg.
Fonte: BORDIN et al., 2007, p. 479.
Existem métodos por biologia molecular utilizados para a detecção do DNA do HBV, como por exemplo, a técnica de hibridação e reação em cadeia da polimerase (PCR), sendo o PCR muito mais sensível que a técnica de Hibridação, cerca de dez mil vezes mais sensível (FERREIRA; ÁVILA, 2001, p. 79).
As imunizações ativa, passiva ou ativo-passiva, em curto período de tempo após a exposição ao HBV pode prevenir as infecções, a aplicação da vaicna anti-HBV nas primeiras 12-24 horas após a exposição, pode ser eficácia em até 70 á 90%, bom como a associação da vacina e Gamaglobulina hiperimune (HBIG). A vacina de HBIG pode significar 70 á 90% de proteção se administrada em até sete dias após exposição percutânea, e também pode ser de valor se administrada em até duas semanas após contato sexual, e em recém nascidos de mães AgHBs positivos é obrigatório a vacinação, juntamente com á HBIG, é constatada maior eficácia na profilaxia, dentro de 24 horas após o nascimento, ou um eventual acidente (FERREIRA; SILVERA, 2004, p.482).
A imunoglobulina para Hepatite B (HBIG = Hepatitis B immune globulin) e preparada a partir do soro de paceintes que se recuperam do HBV, sendo esse o motivo de seu alto título de HBsAG, ela oferece proteção passiva imediata aos indivíduos que tiveram exposição ao HBV (LEVISON et al, 2005, p. 270).
O tratamento convecional da α-interferona por via SC (subcutβnea), doses diárias três vezes por semana, o que resulta no desaparecimento do HBeAg em 10% dos pacientes e do DNA HBV em 30 a 40% . A terapia é indicada aos pacientes com HBV crônica com HBsAg e DNA do HBV no soro, assim como elevações dos níveis séricos das aminotransferases , mas é conta-indicada em pacientes com cirrose avançada pacientes receptores de transplante de órgãos sólidos, imunosupremidos e que apresente qualquer tipo de doença grave. A terapia também não é recomendada a pacientes com níveis séricos de aminotransferases normais, ou quase normais, pois a mesma pode ser inefetiva nessa situação (BENNETT; GOLDMAN, 2001, p. 879).
Com esse tratamento convencional, os níveis de DNA do HBV geralmente declinam, e em pacientes com resposta satisfatória, ocorre geralmente um agravo com aumento das transaminases , coincidindo com uma queda dos níveis de DNA viral e desaparecimento do HBeAg. Os níveis séricos de transaminases normalizam-se, e em parte dos pacientes, ocorre perda do HBsAg, muitos meses, ou anos após o desaparecimento do HBeAg, e raramente ocorre a reativação da doença (BENNETT; GOLDMAN, 2001, p. 879).
O Recombinax é uma vacina que contém HBsAg produzido por leveduras mediante técnicas de engenharia genética, sendo muito eficaz na prevenção do HBV, além de ter poucos efeitos colaterais, sendo indicada aos pacientes que sofreram exposições ao sangue contaminado, incluindo aqueles que receberam múltiplas transfusões sanguíneas (LEVINSON et al., 2005, p. 270).
É possível observar uma redução de incidência de casos de carcinoma hepatocelular em países onde houve imunização disseminada como citado por Levinson et al (2005, p. 270), e Ferreira e Silveira (2004, p. 481) afirmam que a vacinação contra o HBV é a maneira mais eficaz para se prevenir contra a infecção, e eliminar a transmissão em todas as faixas etárias.
Logo após a descoberta do antígeno Austrália (HBV) em 1965, outros marcadores foram detectados no soro, obtendo assim, um melhor diagnóstico para a Hepatite B, e ocorrendo de forma semelhante com a Hepatite A. No ano de 1974 ficou evidente a existência de outros vírus causadores de Hepatite, com marcadores sorológicos negativos tanto para o HBV quanto para o HAV, utilizando assim, o termo Hepatite não-A, não B inicialmente (MENDES; PITTELLA, 1994, p. 79).
Durante os 15 anos seguintes, diversos estudos epidemiológicos, clínicos e anatopatológicos auxiliaram na caracterização desse novo vírus, porém, apesar do grande esforço na busca dos marcadores sorológicos, não se obteve resultados significativos, conseguindo isso somente no final dos anos 80 com a utilização de engenharia genética, com a qual foi possível fazer o isolamento de uma proteína específica, que permitiu detectar um anticorpo contra esse vírus não-A, não-B (MENDES; PITTELLA, 1994, p. 79).
Segundo Alterthum e Trabulsi (2006, p. 613), o reconhecimento do vírus da Hepatite C é recente, e com a constatação de um grande número de casos de Hepatite não-B associada a transfusões e em viciados de drogas, sendo o período de incubação deste também, de sete a oito semanas, intermediário entre os períodos de incubação da infecção por HAV (três a quatro semanas) e da infecção por HBV (doze a quatorze semanas), criando assim a denominação Hepatite não-A não-B, e as descrições do vírus responsáveis pelas Hepatites C e E.
De acordo com Stites et al (2004, p. 550).
O HCV, foi descoberto em 1989, é um vírus RNA de filamentos simples e sentido positivo, originalmente considerado como membro da família Flaviridae. O HCV foi descoberto pela extração de todo ácido nucléico do plasma de um chipanzé com Hepatite não-A não-B, seguida de transcrição reversa do RNA em DNA e clonagem do produto. O RNA codifica uma única poliproteína grande codificada por uma estrutura de leitura aberta, que é clivada proteoliticamente. A estrutura de leitura aberta codifica três proteínas estruturais N-terminais (NS) C-terminais (incluindo NS2, NS3, NS4 e NS5), que são necessárias á replicação do vírus. As regiões que codificam as proteínas do envelope E1 e E2 são altamente variáveis. Foram identificados seis genótipos principais, com pelo menos, 50 subtipos. O tipo 1 é o mais prevalente nos Estados Unidos. A evolução clínica e a resposta á terapia estão associadas ao genótipo.
Podem ocorrem também que um mesmo indivíduo possua diversas variantes ou quase espécies geneticamente distintas. Essas quase-espécies mais complexas correspondem a uma maior duração da infecção, níveis plasmáticos mais elevados do vírus e resposta mais insatisfatória ao tratamento (STITES et al,2004, p. 550).
As características genéticas e biológicas do vírus da Hepatite C, ou HCV, permitem sua inclusão na família Flaviridae, gênero Hepacivirus, espécie Hepatitis C virus. Suas partículas virais são esféricas e têm 50 nm de diâmetro e contêm um envelope lipoprotéico, o core viral é esférico e possuí aproximadamente 30 nm, sem ainda muitas determinações sobre os detalhes desses virions. O genoma viral contém uma molécula de RNA de fita simples de polaridade positiva. O virion é constituído de pelo menos três proteínas que são a proteína C (p19), do nucleocapsideo (core) e duas glicoproteinas de envelope E1 (gp31) e E2 (gp70), codificadas pela porção aminoterminal do genoma viral, podendo ainda codificar, na terminação 3´, seis proteínas não estruturais (NS2-NS3-NS4A-NS4B-NS5A-NS5B) (ALTERTHUM; TRABULSI, 2004, p. 613). A figura 17 representa uma ilustração esquemática do vírus da Hepatite C.
Figura 17. Vírus da Hepatite C
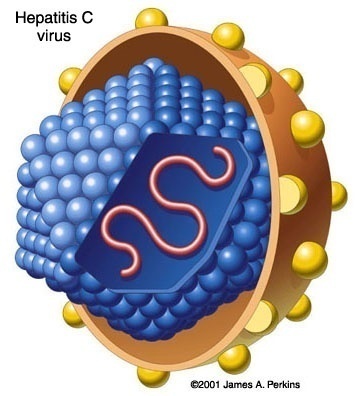
Fonte: http://www.rit.edu/~japfaa/infectious.html
1.1.8 Ciclo Replicativo do HCV
Alterthum e Trabulsi (2004, p. 613), bem como Levinson et al. (2005, p. 272), citam que não existe um sistema eficiente para o cultivo de HCV, não sendo possível um estudo antigênico muito detalhado do vírus, e não sabendo ao certo da existência de seus sorotipos, mas recentemente, o Journal of viral Hepatitis (2007, p. 8) publicou um artigo sobre estudos de replicação viral do HCV in vitro, no qual pesquisadores, através de técnicas de biologia molecular e cultura em células, fizeram experimentos para compreender melhor os ciclos de vida dos genótipos do HCV, abrindo também portas para novos estudos para o melhor entendimento desses mecanismos virais.
Outros flavivírus replicam-se no citoplasma e traduzem o seu genoma RNA como proteínas longas, na qual são clivadas e geram as proteínas funcionais, possivelmente a replicação do HBV siga o mesmo padrão (LEVINSON et al, 2005, p. 272).
As regiões conservadas do genoma têm sido estudadas e utilizadas para a classificação dos vírus em seis genótipos (1 a 6) e mais de 50 subtipos (1ª, 1b, 1c etc.). O HCV é inativado pela exposição ao calor, a 60ºC, por dez horas ou a 100ºC por dois minutos e é relativamente instável á temperatura ambiente (ALTERTHUM; TRABULSI, 2004, p. 613).
Acredita-se que o HCV infecta principalmente os hepatócitos e os linfócitos B, apesar de não se ter identificado ainda qualquer receptor celular. Alguns dados recentes mostram que o HCV liga-se ao CD81 através de uma proteína chamada E2 do envelope, mas não se sabendo ao certo se essa ligação é seguida de penetração e infecção. É mais provável que a destruição dos hepatócitos seja devido ao ataque de células T citotóxicas, onde á exemplo do HBV a resposta imunológica aos antígenos é considerada responsável pela eliminação do vírus e patogenia da doença (STITES, 2004, p. 550).
Na fase aguda da infecção por HCV há uma resposta intensa das células TCD4 e CD8, particularmente da atividade dos CTL CD8 no fígado. A eliminação do vírus não ocorre devido à resposta imunológica antiviral fraca aos antígenos virais, com a ausência da erradicação das células infectadas, além de que a variabilidade genética do HBV possa ser responsável pela persistência do vírus, de grande importância para facilitar a o escape do vírus frente à vigilância imunológica, além de codificar proteínas que ajudam em sua evasão do sistema imune. As respostas mediadas pelas células CD4 e CD8 HCV especificas são vigorosas durante a infecção crônica, sugerindo que possa ocorrer persistência do vírus mesmo frente a uma resposta ativa de células T. Os CTL CD8 HCV- específicos são responsáveis tanto pela erradicação viral, quanto pela lesão hepática uma vez estabelecida a infecção crônica (STITES, 2004, p. 550).
O período de incubação da Hepatite C é de mais ou menos sete semanas, mas também pode variar de duas a vinte e seis semanas, podendo essa infecção ser subclínica ou até fulminante. As manifestações clínicas ocorrem em apenas um terço dos infectados, e são semelhantes as demais Hepatites virais. A persistência do vírus ocorre em aproximadamente 80% das infecções, das quais 20% evoluem para Hepatite crônica ativa e cirrose, mesmo que não haja manifestação clínica aparente (ALTERTHUM; TRABULSI, 2004, p. 613).
Esses dados epidemiológicos sobre a evolução da infecção por HCV são variáveis, de acordo Levinson (2005, p. 272) e diversas outras literaturas, o HCV representa uma forte predisposição ao carcinoma hepatocelular, mas não existem evidencias da presença de um oncogene no genoma viral ou da inserção de cópias desse genoma no DNA da célula cancerosa. Apesar da presença dos anticorpos contra HCV, aproximadamente 75% dos pacientes está infectada de forma crônica e continuam a produzir vírus durante pelo menos um ano, e onde aproximadamente 10% desses pacientes desenvolvem Hepatite ativa e cirrose. Não sabendo se os pacientes que se restabelecem da doença são passíveis de reinfecção ou se a imunidade gerada é duradoura.
Os fatores que influenciam a progressão do HCV incluem a idade de ocorrência da infecção, o sexo e o estado imunológico do individuo. A infecção crônica pelo HCV caracteriza-se por níveis séricos flutuantes das transaminases. Recomenda-se a realização de biópsia para avaliar a gravidade da doença antes de iniciar qualquer tratamento antiviral (STITES, 2004, p. 550).
O tempo médio entre infecção e o desenvolvimento de carcinoma hepatocelular é de 30 anos. Em pacientes com hepatopatias em estado terminal, deve-se considerar o transplante de fígado, onde a recaída da infecção pelo HCV após o transplante é quase universal, e não parece afetar a sobrevida dos pacientes (STITES, 2004, p. 550).
As manifestações clínicas da infecção aguda causadas pelo HCV são mais brandas que as manifestações do HBV, sendo, febre, vômitos, anorexia, náusea e icterícia os sintomas mais comuns. Fezes claras, urina escura e níveis elevados de transaminases também são indicativos. Como a maioria das vezes a infecções tanto aguda como crônica são assintomáticas, é possível a detecção apenas pela presença e investigação de anticorpos. A infecção por HCV também leva reações auto-imunes significantes, incluindo, artralgias, vasculites, púrpura e glomerolonefrite membranopoliferativa. O HCV é a causa principal da crioglobulinemia essencial mista. Os crioprecipitados são freqüentemente compostos de antígenos de HCV e anticorpos (LEVINSON, 2005, p. 273).
Um quarto dos pacientes com hepatopatia alcoólica avançada apresenta anticorpos contra HCV, embora os índices variem em diferentes áreas geográficas, o álcool pode agravar a evolução da Hepatite C crônica, está relação não está explicada, e a possibilidade de HCV ser responsável pelos casos chamados de cirrose alcoólica é intrigante, sendo um fator de risco importante para o desenvolvimento de carcinoma hepatocelular (RUBIN, 2006, p. 781).
Os pacientes que apresentam cirrose inexplicada e carcinoma hepatocelular apresentam alta prevalência de anti-HCV, excedendo 50%, e se comparamos ao HBV, a progressão para doença crônica ou cirrose subseqüente, o HCV também excede 50%. Assim, o HCV pode ser de fato, a principal causa infecciosa de hepatopatia crônica no mundo ocidental (ROBBINS et al, 2001, p. 773).
 Página anterior Página anterior |   Voltar ao início do trabalho Voltar ao início do trabalho | Página seguinte  |
|
|
|