 Página anterior Página anterior |   Voltar ao início do trabalho Voltar ao início do trabalho | Página seguinte  |
Quadro 1 - Casos de envenenamento por carne ou fígado contaminados por promotores de crescimento
|
Local e data |
Alimento e níveis de contaminação |
Nº de pessoas envenenadas |
Sintomas |
|
Espanha, 1990 |
Fígado (0,16 a 0,30 ppm) |
135 |
Tremores, palpitações, nervosismo e taquicardia |
|
Espanha, 1994 |
Fígado |
127 |
Não especificado |
|
França, 1990 |
Fígado (0,38 a 0,50 ppm) |
22 |
Tremores, dores de cabeça, palpitações, vertigens |
|
Itália, 1995 |
Carne de traseiro (> que 0,50 ppm) |
16 |
Tremores, palpitações, nervosismo e taquicardia |
WITKAMP (1996)
Os ruminantes são considerados animais "gastricamente evoluídos" por conterem um estômago com quatro compartimentos, sendo o rúmen, o principal responsável por esta classificação. Ocorre que a existência do rúmen permite a ingestão e digestão parcial de carboidratos estruturais, principalmente da celulose e hemicelulose, material abundante na face da terra, porém sem utilização direta pelo homem. Esta digestão diferenciada explica-se pela presença, no rúmen, de uma fauna e flora microbiana constituída de bactérias, protozoários e fungos que convivem em simbiose com o animal.
Dentre os microrganismos presentes, as bactérias desempenham papel fundamental na digestão dos alimentos ingeridos pelo animal. Por intermédio da fermentação ruminal dos carboidratos estruturais e solúveis, da proteólise, da desaminação e do aproveitamento de fontes de Nitrogênio Não Protéico, feitos, a princípio, para possibilitar suas multiplicações (o que o zootecnista denomina de produção de proteína microbiana), acabam produzindo, através da disponibilidade de amônia e alfa cetoácidos, a principal fonte de energia para os ruminantes que são os Ácidos Graxos Voláteis (AGV). Ocorre que o processo de síntese de proteína microbiana tem um custo energético. Assim, no processo de produção de AGV, essa energia gasta é reposta para a continuidade do crescimento microbiano (Figura 2).
Os microrganismos sintetizam, também, aminoácidos e algumas vitaminas, essenciais ao animal hospedeiro. Institui-se a interação denominada simbiose.
"Potencializar essa simbiose através de manipulações ruminais, objetivando obter melhor desempenho animal (principalmente produção de leite e carne) é uma das principais tarefas do nutricionista de ruminantes."
Um dos caminhos encontrado para melhorar o desempenho animal, através da manipulação dos microrganismos, é o de inibir o crescimento de bactérias Gram-positivas responsáveis por alguns processos de fermentação ruminal considerados ineficientes ou mesmo prejudiciais. Dentre esses processos que devem ser minimizados, inclui-se a degradação da proteína do alimento. Faz-se importante que parte dessa proteína, na forma de proteína verdadeira, uma vez ingerida, escape à digestão no rúmen, devida ao ataque dos microrganismos, e seja aproveitada pelo último saco gástrico (abomaso), onde ocorre a digestão enzimática do alimento, com posterior absorção no intestino delgado. O escape dessa proteína verdadeira ao ataque de microrganismos gera uma diminuição do acúmulo de amônia no rúmen e da excreção de uréia na urina. A excreção de uréia causa perda energética, diminuição da eficiência de utilização do nitrogênio alimentar e, em casos onde há maiores concentrações de animais, a contaminação do solo, cursos de água e de plantas.
Deve-se ter o conhecimento de que a quantidade e combinação dos diferentes nutrientes na dieta total dos animais, assim como o nível de produção desses, são fatores que determinam a maior ou menor necessidade de Proteína Degradada no Rúmen (PDR) e, dessa feita, a de proteína "By pass" (de escape), denominada Proteína Não Degradada no Rúmen (PNDR). Um exemplo são as vacas leiteiras que produzem trinta ou mais kg de leite/dia. Essas necessitam de um escape em torno de quarenta por cento da proteína total verdadeira.
A inibição dessas bactérias Gram-positivas causa outros efeitos benéficos, por meio, por exemplo, da inibição das bactérias produtoras de ácido lático, com o favorecimento do aumento das consumidoras desse ácido produzido, o que diminui consideravelmente os riscos da ocorrência de um distúrbio de ordem metabólica, denominado acidose lática. Esse efeito combinado possibilita que os animais suportem uma maior relação concentrado/volumoso na dieta, por haver um controle da diminuição excessiva do pH ruminal. Diversas são as ocasiões de manejo nas quais se faz necessário o aumento na quantidade de ração concentrada na dieta. Pode-se considerar aqui a fase de transição, também denominada de fase pré e pós-parto em ruminantes, uma ocasião determinante, em que há uma necessidade de certa redução da quantidade de volumoso consumida, compensada pelo aumento do consumo de concentrado. Essa alteração na relação volumoso/concentrado se faz necessária para o caso referido, por ocorrer, no terço final da gestação de caprinos, ovinos, bovinos e bubalinos (principais espécies de ruminantes domesticados para produção), um crescimento singular do feto. Qual seja, durante dois terços do tempo total de uma gestação, somente um terço do desenvolvimento do feto ocorre, enquanto que no restante final da gestação, observa-se um desenvolvimento de dois terços do peso final. Esse desenvolvimento do feto resulta numa compressão do espaço ruminal, diminuindo sua capacidade volumétrica. A diminuição da ingestão em bovinos é da ordem de trinta por cento, principalmente nos trinta dias que antecedem o parto, sendo de quinze por cento em caprinovinos, por volta de uma a duas semanas pré-parto. Normalmente o nutricionista busca aumentar a densidade volumétrica da dieta no terço final da gestação, ou seja, conseguir que em um menor volume de espaço ruminal, caiba a mesma quantidade em quilocalorias (Kcal) que atenderia as necessidades energéticas em situação de espaço ruminal normal. Porém, somente se alcança resultados favoráveis à produção se esse manejo alimentar for realizado de forma gradativa, dando suporte à necessária adaptação da microbiota ruminal. O cuidado com a velocidade e amplitude de variação do pH ruminal é fator preponderante para a estabilização relativa dessa microflora e fauna.
Obtêm-se assim, vários benefícios com esse manejo. Uma conseqüência do manejo estratégico acima citado é a menor necessidade de mobilização de gordura corporal das matrizes ovinas no pré e pós-parto, principalmente as com partos gemelares, reduzindo consideravelmente a ocorrência de toxemia da gestação (aborto pré-parto) e a de acetonemia pós-parto nessas matrizes. A menor mobilização de gordura corporal das matrizes de ruminantes nessas fases de criação é sinônimo de manutenção de Escore de Condição Corporal (ECC) adequada que, por sua vez, garante boa produção leiteira para assegurar o bom desempenho ponderal das crias e a recuperação do aparelho reprodutivo para nova concepção, dentro dos índices zootécnicos preconizados para cada espécie.
A inibição das bactérias gram-positivas causa um outro efeito benéfico, tanto ao desempenho do animal, quanto à poluição ambiental que é a diminuição da produção de metano (gás responsável pela destruição da camada de ozônio). Segundo LANA et al. (1998), a produção indesejável de gás metano pelas bactérias ruminais e intestinais pode corresponder a uma perda energética de até 13% em relação à energia do alimento ingerido. Com relação à poluição ambiental deve-se considerar o fato de que um bovino adulto chega a produzir mais de 400 litros de gás por dia ( metano + dióxido de carbono), liberado no meio, principalmente por eructação e que hoje o rebanho bovino mundial é de mais de 1 bilhão de cabeças. MADIGAN et al. (1997) alertaram para o fato dos ruminantes serem os animais que mais contribuem para a emissão de metano na atmosfera, na proporção de 27%.
Dentre as alternativas para se manipular o rúmen com vistas a controlar a atividade e o crescimento das bactérias gram-positivas, existe a possibilidade de utilização de antibióticos ionóforos, principalmente monensina e lasalocida. Seus nomes comercias são, respectivamente, Rumensin₢ e Taurotec₢. Estes foram citados no início desse trabalho como sendo aditivos não nutrientes e modificadores da fermentação microbiana ruminal.
A forma de ação inibitória desses antibióticos sobre as bactérias gram-positivas (efeito bacteriostático) se dá através da catalisação das trocas de sódio e prótons ou prótons e potássio na membrana (PRESSMAN, 1976). Não apresentam a mesma ação sobre as bactérias do Gênero Gram-negativas porque suas paredes celulares apresentam uma membrana externa, de natureza lipopolissacarídica, (RUSSELL e STROBEL, 1988) que impede essa catalisação.
Figura 2 – Movimento de íons através da membrana de bactérias Gram-positivas.
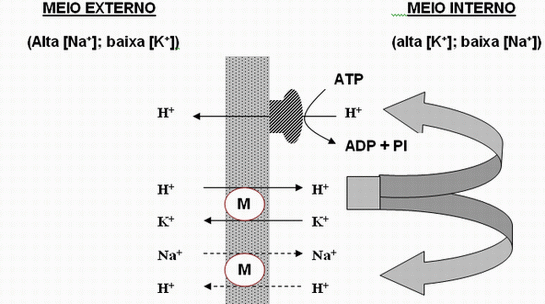
Como pode ser observado na Figura acima, os antibióticos com propriedades ionóforas são capazes de mudar a direção dos íons e facilitar seus movimentos, funcionando como carreadores móveis dentro da membrana e movimentando milhares de íons por segundo (PRESSMAN, 1976). O movimento de íons através da monensina recebe a denominação de "antiporte próton - sódio", mas também tem a capacidade de translocar íons potássio (FELLNER et al., 1997).
Segundo RUSSELL (1996), a monensina inibe o crescimento da bactéria gram-positiva Streptococcus bovis que está relacionada com acidose aguda no rúmen, sendo as utilizadoras de lactato, resistentes (RUSSELL e STROBEL, 1988). NAGARAJA et al. (1997) consideram serem sensíveis à monensina, não somente a Streptococcus bovis, mas também a Lactobacillus spp, principais produtoras de ácido lático no rúmen.
Esta substância inibe ainda as bactérias produtoras de hidrogênio e formato (RUSSELL e STROBEL, 1989). Considerando que os antibióticos ionóforos não são inibidores das bactérias metanogênicas (CHEN e WOLIN, 1979, citados por NAGARAJA et al., 1997), a diminuição na metanogênese pode ser atribuída à redução dos precursores (H2 e formato).
O efeito dos antibióticos ionóforos (monensina) na inibição da produção ruminal de amônia foi inicialmente observado por DINIUS et al. (1976). Resultados de trabalhos in vitro têm demonstrado diminuição no crescimento de bactérias proteolíticas e, consequentemente, na desaminação, com conseqüente diminuição na produção de amônia no rúmen. (variação de 33 a 36%), quando incubada num meio contendo 15 g/L de caseína hidrolisada (CHEN e RUSSELL, 1991; YANG e RUSSELL, 1993a). Em experimentos com animais, a redução na produção de amônia variou de 28 a 54% (YANG e RUSSELL, 1993b, LANA e RUSSELL, 1997). Por sua vez, a atividade específica de produção de amônia (AEPA), nesses dois últimos experimentos, variou de 18 a 38%.
Com as modificações na fermentação ruminal, os ionóforos melhoram a eficiência alimentar, podendo essa se dar, ou pela menor ingestão de alimentos e mesmo ganho de peso para animais confinados ou pela mesma ingestão com maiores ganhos, quando os animais se encontram em pastejo (MORAES et al., 1993).
Reiterando, apesar dos resultados apresentados serem praticamente determinantes no alcance de maior margem de lucro, dentre a vasta gama de exigências impostas pelos mercados importadores dos produtos de origem animal, a observância de que os animais tenham sido alimentados com rações isentas de antibióticos aditivos e promotores de crescimento mostra-se a principal delas. Este tipo de exigência já se observa também no mercado interno através de movimentos de associações de consumidores. Logo, a busca e utilização de aditivos naturais que possam suprir, ao menos em equivalência, o uso desses antibióticos no quesito produtividade, traria consigo o diferencial de qualidade, por isentar os produtos de qualquer toxicidade, favorecendo o ganho em competitividade para esses produtos.
A própolis é um produto natural proveniente de substâncias (resinas) coletadas das plantas, pelas abelhas, e misturadas com suas secreções. As abelhas modificam a composição original da resina da planta misturando-as com secreções das glândulas hipofaringeais, especialmente -glicosidases. Desta forma, os flavonóides heterosídeos são hidrolisados para a forma de agliconas livres, o que aumenta a ação farmacológica destes compostos (BONHEVI et al., 1994; PARK e IKEGAKI, 1998).
Tem sido objeto de estudo em diversos países por tratar-se de um subproduto da apicultura que tem demonstrado importantes propriedades terapêuticas, como atividade antiviral, antifúngica, antiprotozoário (Quadro 2), além da atividade antibacteriana que será apresentada e discutida na seqüência.
Quadro 2 - Relação de alguns estudos sobre as diversas atividades terapêuticas da própolis
|
EXTRATO
|
|
|
Antiviral |
França/ Etanólico |
AMOROS et al. (1992a) |
|
França/ Etanólico |
AMOROS et al. (1992b) |
|
|
Alemanha/ Etanólico |
HEINZE et al. (1998) |
|
|
Antifúngica |
Cuba/Aquoso e Etanólico |
VALDES et al. (1987) |
|
Polônia/ Tabletes |
DOBROWOLSKI et al. (1991) |
|
|
Brasil/ Etanólico |
HOFFMANN et al. (1998) |
|
|
Antiprotozoário |
Polônia/ Tabletes |
DOBROWOLSKI et al. (1991) |
|
Sigma/ Etanólico e Dimetilsulfóxido |
HIGASHI e CASTRO (1994) |
|
|
Sigma/Aquoso e Etanólico |
CASTRO e HIGASHI (1995) |
|
|
Brasil/Aquoso |
MORONI et al. (1999) |
|
|
Antiprotozoário |
Polônia/ Etanólico |
KROL et al. (1990) |
|
Brasil/ China/ Japão/ EUA/ Metanólico |
YAMAUCHI et al. (1992) |
|
|
Brasil/Aquoso e Metanólico |
MATSUSHIGE et al. (1996) |
|
|
Brasil/ Aquoso |
MATSUNO et al. (1997) |
|
|
Brasil/ Aquoso |
SAID (1998) |
|
|
Brasil/ Aquoso |
MATSUNO et al. (1997) |
|
|
Bulgária/ Aquoso |
IVANOVSKA et al. (1995) |
|
Brasil/ Aquoso |
TATEFUJI et al. (1996) |
|
|
Brasil/ China/Japão Aquoso e Etanólico |
MIYATAKA et al. (1998) |
|
|
|
Polônia/ Tabletes |
DOBROWOLSKI et al. (1991) |
|
Brasil/ China/Japão Aquoso e Etanólico |
MIYATAKA et al. (1997) |
|
|
Analgésica |
Brasil/ Etanólica |
MARCUCCI et al. (1999c) |
|
Brasil/ Etanólico |
OKUYAMA et al. (1999) |
|
|
|
Brasil/ Etanólica |
MARCUCCI et al. (1999c) |
|
|
Brasil/Etanólico |
DAMIAN et al. (1999) |
|
|
Brasil/Aquoso e Metanólico |
MATSUSHIGE et al. (1996) |
|
Brasil/ Compostos identificados |
RAICHASKI et al. (1999) |
Segundo MARCUCCI (1995), um grande número de substâncias tem sido encontrado nas amostras de própolis: ceras, resinas, bálsamos, óleos aromáticos, pólen e outras substâncias orgânicas. É composta, em média, por 55% de resinas e bálsamos, 30% de ceras, 10% de óleos voláteis e 5% de pólen (IOIRISH, 1975; NIKOLAEV, 1975; GHISALBERTI, 1979; GRANGE e DAVEY, 1990; BONVEHI et al., 1994).
Possui uma composição química complexa, contendo mais de 160 componentes. Dentre os compostos químicos identificados, podem ser citados os flavonóides (flavonas, flavolonas e flavononas), chalconas, ácido benzóico e derivados, benzaldeídos, álcoois, cetonas, fenólicos, heteroaromáticos, álcool cinâmico e derivados, ácido cafeico e derivados, ácidos diterpenos e triterpenos, minerais e outros (WALKER e CRANE, 1987; BONVEHI et al., 1994; MARCUCCI, 1995; BANKOVA et al., 1998; SEIXAS et al., 2000; SOARES et al., 2000).
Diversos autores atribuem aos flavonóides (flavonas, flavolonas e flavononas), a maior capacidade de atuarem como agentes antiviróticos, antiparasitários, antibacterianos e antioxidantes, propriedades farmacológicas observadas na própolis (GRANGE e DAVEY, 1990; BONVEHI et al., 1994; LANGONI et al., 1994; BANKOVA et al., 1995).
Ao contrário da própolis de regiões temperadas do mundo, onde o "choupo" (Populus sp.) é sua única fonte, no Brasil há uma maior diversidade de plantas que as abelhas podem adotar como fonte de própolis e em diferentes regiões. Assim, sua composição química pode diferir entre uma amostra e outra. KOO e PARK (1997) procuraram avaliar amostras de própolis advindas de diferentes regiões do Brasil, vindo esses autores a constatar a presença de quantidades diferentes de certos flavonóides na forma de agliconas em suas composições. Nesse trabalho foram encontrados valores que variaram de 23,71 até 48,46 mg de flavonóides por grama de própolis, tendo a própolis da "região sudeste" apresentado o maior valor, enquanto que à própolis do sul coube o menor valor (baixa diversidade de plantas visitadas pelas abelhas).
Foi na forma de "ineditismo", que nos anos 2000-2001, se deram, na Universidade Federal de Viçosa (UFV), Minas Gerais, os primeiros estudos buscando avaliar a própolis como possível agente bacteriostático sobre a microbiota ruminal. Assim, em 2001, algumas respostas às indagações da possível ação antimicrobiana da própolis são dadas na forma de uma publicação intitulada "Ação da própolis sobre microorganismos ruminais desaminadores de aminoácidos e sobre alguns parâmetros de fermentação no rúmen", feita nos Anais da XXXVII Reunião Anual da Sociedade Brasileira de zootecnia (vide citação STRADIOTTI et al., 2001). Até esse momento, tinha-se somente o conhecimento de três trabalhos testando-a como agente antimicrobiano em ruminantes, mas relacionados com bactérias responsáveis pela incidência de mastite em vacas leiteiras. Em dois deles, os de LANGONI et al. (1994) e VARGAS et al. (1994), os ensaios experimentais foram realizados in vitro, com respostas promissoras para a continuidade dos estudos. Já, PINTO (2000) trabalhou com aplicações de soluções alcoólicas de própolis nos tetos com mastite de vacas leiteiras. Embora tenha observado efeito positivo do extrato de própolis, o mesmo relata a ocorrência de forte purulência nos tetos tratados. O uso desse subproduto apícola, via teto, fica vinculado à resolução desse efeito colateral.
Quanto ao estudo da própolis como possível modificadora da fermentação microbiana ruminal, fundamentou-se a hipótese inicial nas seguintes premissas: se a própolis atua sobre as bactérias Gram-positivas, presume-se que a sua adição à ração e em cultivos de microrganismos In vitro, assim como ocorre com os ionóforos, possa vir a inibir o crescimento de bactérias proteolíticas e, consequentemente, a desaminação e a proteólise. Presume-se que possa ocorrer a inibição de bactérias produtoras de lactato, o que permitiria ao nutricionista explorar melhor o vigor produtivo dos animais através do aumento da quantidade de concentrado na ração, sem riscos de ocorrência de acidose lática. Por fim, presume-se, ainda, a possibilidade de uma inibição direta ou indireta da produção de metano, com conseqüente economia de energia no processo digestivo do animal, além da diminuição da poluição ambiental.
Por tratar-se de substância natural e, em sendo efetiva sua aplicação como aditivo para a nutrição de ruminantes, a própolis agregaria aos produtos animais resultantes de seu uso, o diferencial de qualidade, vindo a fortalecer a aceitação e comercialização desses produtos. Como agente antimicrobiano ruminal, estaria ainda, de forma indireta, reduzindo a poluição ambiental, através da redução das perdas por fermentação (metano e amônia).
Na obtenção do extrato de própolis, inicialmente faz-se a limpeza da pedra bruta (Figura 3), também denominada retirada da borra, promove-se a moagem a frio da mesma (Figura 4) e coloca-se solução alcoólica 70% (técnica de extração em etanol hidratado) sobre o material moído em recipiente (Figura 5), de preferência por um período de extração de 30 dias. Importante evitar incidência de calor e luz, fazendo-se adequada vedação do recipiente. Posteriormente a esse período, faz-se a filtragem em papel de filtro, obtendo-se a solução estoque. Esta solução fica disponível para aplicar diluições sobre a mesma. Para efeito de parâmetro, STRADIOTTI Jr. et al. (2001), ao utilizarem 16,7; 33,3; 50,0; 66,7; 83,3 e 100,0% da mesma, obtiveram melhores resultados com o uso de 33,3 e 66,7%. Para esses estudos foram utilizadas 30 gramas de própolis bruta triturada para cada 100 mL de solução alcoólica (etanol hidratado 70%).
Figura 3 - Pedra bruta de própolis Figura 4 – Moagem a frio


Figura 5 – Extração com Solução Alcoólica

(em substituição aos antibióticos ionóforos)
Quanto à aplicabilidade da própolis como aditivo natural não nutriente para ruminantes e seus efeitos sobre a população microbiana ruminal, STRADIOTTI Jr. et al. (2001), objetivaram, inicialmente, determinar a ação in vitro (experimento 1) e in vivo (experimento 2) da própolis sobre a atividade específica de produção de amônia (AEPA) ou atividade de desaminação de aminoácidos e sobre a fermentação ruminal em bovinos.
No experimento 1, o extrato de própolis obtido com etanol a 70% em água foi mais eficiente que a 99,5%, obtendo-se valores de até 78% de inibição da AEPA, in vitro, em relação ao controle (somente etanol 70% e 99,5%). Em trabalhos in vitro, a monensina (5 micro molares) diminuiu de três a 36% a AEPA, pela população microbiana, quando incubada em um meio contendo 15 g/L de caseína hidrolisada (Chen & Russell, 1991; Yang & Russell, 1993), valores inferiores aos observados no presente trabalho.
No experimento 2, a ação da própolis, in vivo, sobre a fermentação ruminal e AEPA, utilizou-se quatro novilhos Holandeses, em dois períodos experimentais, sob dieta contendo 35% de concentrado, submetidos aos tratamentos controle e com extrato de própolis. O extrato de própolis não afetou o consumo de matéria seca, o pH ruminal e a proteína microbiana. Entretanto, o extrato de própolis aumentou a concentração de AGV totais e inibiu a AEPA pelos microrganismos ruminais (Tabela 1), indicando que existe o potencial deste efeito ocorrer em outras situações, como em dietas contendo alta taxa de proteína degradável/carboidrato fermentescível, observado em pastagens novas de gramíneas ou pastagens de gramíneas consorciadas com leguminosas. Em linhas gerais, confere aos ruminantes, maior possibilidade de se manterem e produzirem a partir de uma mesma dieta.
Tabela 1- Efeito do extrato de própolis sobre o consumo de matéria seca (CMS), pH, proteína microbiana e ácidos graxos voláteis total (AGVT) ruminais em novilhos e atividade específica de produção de amônia (AEPA), por microrganismos ruminais.
|
Tratamentos |
||||
|
Parâmetros |
Controle |
Própolis |
EPM |
P< |
|
CMS (kg/animal/dia) |
10,88 |
10,52 |
1,487 |
0,870 |
|
pH ruminal |
6,36 |
6,52 |
0,105 |
0,310 |
|
Proteína microbiana (mg/l) |
2997,20 |
3076,20 |
194,029 |
0,780 |
|
AEPA (nmol/mg PM/minuto) |
11,65 |
8,10 |
0,373 |
0,001 |
|
AGV Total (mM) |
60,8a |
94,8b |
1,24 |
0,001 |
EPM = erro padrão da média; QMR = quadrado médio do resíduo, P = nível significância
STRADIOTTI Jr et al. (2004), através da Coleta de amostras de líquido ruminal, determinaram, in vitro, a produção de gases pelos microrganismos ruminais na ausência ou presença de própolis e monensina. Pode-se observar, atravez da Tabela 2, o efeito de tratamento sobre o volume final total de gases. Os tratamentos testando o nível intermediário (33,3%) e superior de própolis (66,7%), oriundos da diluição da solução estoque de própolis (extração de 3 g de própolis em pedra triturada para cada 10 mL de álcool 70%, durante trinta dias, posteriormente diluída para 50% da mesma), mostraram-se eficientes (P<0,05) em inibir a produção final de gases.
Tabela 2 – Efeito da própolis e monensina sobre a produção total de gases após 72 horas de incubação de 100 mg de volumoso e concentrado em diferentes proporções.
Tratamento Volume Final (Vf)
Controle 40,69 A
Própolis 16,7% 39,80 A
Própolis 33,3% 34,87 B
Própolis 66,7% 22,66 D
Monensina 27,60 C
* A > B comparação entre tratamentos (P< 0,05).
Observa-se, ainda, na Tabela 2, que o nível superior de própolis reduziu em aproximadamente 45% a produção de gases, quando comparado ao tratamento controle. Assim, esse nível torna-se um valor referencial para novos estudos, inclusive com a expectativa de possibilidade de domínio sobre as concentrações e tipos de princípios ativos da própolis utilizada.
De posse do conhecimento da capacidade da própolis
em inibir bactérias causadoras de mastite (PINTO, 2000), e da sua inviabilidade
(até então) de uso via teto, buscar-se-á observar se
parte dos princípios ativos da própolis fornecida via oral (dieta)
chegam ao sangue e ao úbere. Uma vez se confirmando, analisar a sua
eficácia na inibição de bactérias causadoras de
mastite. Devido às alterações que a própolis
provoca na produção total de ácidos graxos voláteis
no rúmen, com tendência de aumento na produção
de propionato, estudos deverão ser realizados para observar as possíveis
mudanças quanti-qualitativas dos sólidos do leite. Continuidade dos estudos com a própolis
Os resultados dos ensaios experimentais acima supracitados, tanto in vitro quanto in vivo, são indicativos de igualdade na capacidade de inibição do crescimento de bactérias Gram-positivas no rúmen, entre a monensina e a própolis, mesmo que em proporções de inibição diferentes. Por outro lado, embora a espectativa seja de que a própolis, a exemplo da monensina, apresente ação ionófora, novos estudos devem ser realizados, inclusive com o objetivo de elucidar essa incógnita, o que possibilitaria fazer uso devidamente racional deste subproduto apícola na manipulação da fermentação ruminal, com vistas a melhorar não somente a produção, mas também a qualidade dos produtos finais para consumo humano.
Autor do Trabalho:
Profº Deolindo Stradiotti Júnior
Formação: Doutorado em Nutrição de Ruminantes - Universidade Federal de Viçosa
Atuação: Profº da Universidade Federal do Espírito Santo – CCA-UFES
jrstradiotti[arroba]cca.ufes.br
 Página anterior Página anterior |   Voltar ao início do trabalho Voltar ao início do trabalho | Página seguinte  |
|
|
|